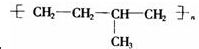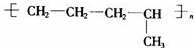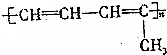题目内容
18.过氧化钙(CaO2 )是一种安全无毒物质,带有结晶水,通常还含有CaO.称取4.88g过氧化钙样品(不含结晶水),灼热时发生如下反应;2CaO2═2CaO+O2↑,得到O2在标准状况下体积为672mL,该样品中CaO2的物质的量为0.06mol,转移电子的物质的量为0.12mol.分析 首先计算氧气的物质的量,根据方程式计算CaO2的物质的量;根据化合价的升降计算转移电子的物质的量.
解答 解:n(O2)=$\frac{0.672L}{22.4L/mol}$=0.03mol,2CaO2═2CaO+O2↑,则n(CaO2)=0.06mol,反应生成1mol氧气转移电子的物质的量是2mol,所以生成0.06mol氧气转移电子的物质的量是0.12mol,
故答案为:0.06mol;0.12mol.
点评 本题考查学生物质的量的有关计算以及氧化还原反应中的电子转移知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.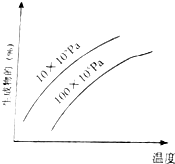 由可逆反应测绘出图象如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
由可逆反应测绘出图象如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
 由可逆反应测绘出图象如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
由可逆反应测绘出图象如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )| A. | 反应物中一定有气体 | B. | 生成物中不一定有气体 | ||
| C. | 正反应一定是放热反应 | D. | 正反应一定是吸热反应 |
9.若以溴乙烷为主要原料制备乙二酸,则经过的最佳途径反应顺序为( )
| A. | 消去-加成-取代-氧化 | B. | 取代-消去-加成-氧化 | ||
| C. | 消去-取代-加成-氧化 | D. | 取代-加成-氧化-消去 |
6.在能使酚酞变红的无色溶液中,可大量共存的离子组是( )
| A. | Na+、Cu2+、Br-、Cl- | B. | K+、NH4+、Cl-、Na+ | ||
| C. | K+、Na+、NO3-、H+ | D. | K+、S2-、SO42-、OH- |
3.下列描述对象所含分子数由多到少的排列顺序是( )
①3g H2
②所含电子的物质的量为4mol的H2
③45g H2O
④常温下,16g O2与14g N2的混合气体
⑤含原子总数约为1.204×1024的NH3.
①3g H2
②所含电子的物质的量为4mol的H2
③45g H2O
④常温下,16g O2与14g N2的混合气体
⑤含原子总数约为1.204×1024的NH3.
| A. | ①②③④⑤ | B. | ③②①④⑤ | C. | ③②⑤①④ | D. | ②③①④⑤ |
10.只含铁和氧两种元素的样品A在高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,过滤,得到沉淀的质量是原样品A质量的$\frac{50}{29}$,则下列说法正确的是( )
| A. | A一定是Fe3O4 | B. | A可能是Fe3O4 | C. | A一定是纯净物 |
17.将下列各组物质按酸、碱、盐分类依次排列,正确的是( )
| A. | 硫酸、纯碱、石膏 | B. | 硫酸、烧碱、胆矾 | ||
| C. | 硫酸氢钠、生石灰、醋酸钠 | D. | 磷酸、熟石灰、苛性钠 |
18.下列有机物的命名正确的是( )
| A. | 2,4,5-三甲基己烷 | B. | 2,3 ___二甲基丁烷 | ||
| C. | 3,3,5,5-四甲基戊烷 | D. | 2,3-二甲基-2-乙基丁烷 |