题目内容
1. 某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.
某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等.(1)氯气可以用于漂白、消毒的原因是因为能与水作用生成具有漂白、消毒作用的次氯酸,相关反应的离子方程式为Cl2+H2O═H++Cl-+HClO.
(2)在调查某室外游泳池夏季池水消毒情况时,小组成员了解到,该游泳池每周一上午8:00换水,然后通入氯气消毒,通常游泳池中水的含氯量(有效氯)控制在0.5mg•dm-1至1.0mg•dm-1之间时,效果最好.如图是该小组测定的每天19:00时游泳池中水的含氯量,哪几天使用游泳池不安全?星期六、星期日.
(3)你认为哪几天的天气炎热、阳光强烈星期四、星期六,说出一种理由2HC1O=2HC1+O2↑阳光强烈时HClO更易分解,致含氯量下降明显(必要的方程式和文字).
(4)小型游泳池通常使用漂白液(NaClO溶液)而非氯气来消毒池水,试举出使用漂白液消毒而非氯气的一项理由NaClO更稳定,便于储存和运输;用化学方程式说明工业上如何生产漂白液?Cl2+2NaOH═NaCl+NaClO+H2O.
分析 (1)利用HClO的强氧化性杀菌消毒;
(2)根据图象判断含氯量是否(有效氯)控制在0.5mg•L-1至1.0mg•L-1之间,在之间的较安全;
(3)因为HClO又有光照易分解的性质:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,使ClO-浓度降低,有效氯降低,杀菌消毒效果不理想.看纵坐标每天的变化量,可见周四、周六下降幅度明显,因此阳光强烈;
(4)因为HClO的见光不稳定性,因此选用其盐溶液杀菌消毒,效果长久且便于储存和运输.
解答 解:(1)氯气可以用于漂白、消毒的原因是因为能与水作用形成具有强氧化性的次氯酸,反应的离子方程式为Cl2+H2O═H++Cl-+HClO,
故答案为:次氯酸;Cl2+H2O═H++Cl-+HClO;
(2)由图中可知,星期六、星期日的含氯量控制在0.5mg/L以下,是不安全的,故答案为:星期六、星期日;
(3)因为阳光强烈时HClO更易分解,致含氯量下降明显,所以导致星期四、星期六的含氯量下降明显,
故答案为:星期四、星期六;2HC1O=2HC1+O2↑阳光强烈时HClO更易分解,致含氯量下降明显;
(4)通常使用漂白液(NaClO溶液)而非氯气来消毒池水的原因是:NaClO更稳定,便于储存和运输,工业用氯气和NaOH反应制备漂白液,反应的方程式为Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:NaClO更稳定,便于储存和运输;Cl2+2NaOH═NaCl+NaClO+H2O.
点评 本题以氯水中HClO的性质为考查对象设置题目,为高频考点,注意把握图中信息和化学知识有机地结合起来进行分析、判断,从而得出正确的结论,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
12.下列反应符合“电解质+电解质=电解质”的是( )
| A. | NH3+HCl═NH4Cl | B. | H2S+Na2S═2NaHS | ||
| C. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 | D. | CO2+NaOH═NaHCO3 |
9.下列有关实验的说法不正确的是( )
| A. | 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化 | |
| B. | 实验室配制FeCl3溶液时,先将FeCl3溶于浓盐酸再加水稀释 | |
| C. | 从海带灰中提取碘时,为了使I-既能完全转化为I2,又对环境无影响,可选H2O2作氧化剂 | |
| D. | 制备硫酸亚铁铵晶体,在蒸发皿中蒸发浓缩溶液时,不能将溶液全部蒸干 |
6.Ⅰ.肼是一种高能燃料.已经各共价键键能(断裂或形成1mol共价键时吸收或释放的能量)如下:
则N2H4(g)+O2(g)?N2(g)+2H2O(l)△H=-583 KJ•mol-1
Ⅱ.密闭容器中进行反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<02反应的化学平衡表达式为K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:600℃时,上述反应的平衡常数K=16.现有如图1甲(恒温恒压)和如图1乙(恒温恒容)两容器,起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡.
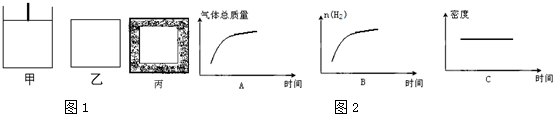
①关于甲、乙容器,下列说法正确的是AB
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4 ,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=0.05mol/(L•min-1)
③平衡后若将乙容器体系温度突然降低100℃,如图2下述图象中能正确反映平衡移动过程中容器内变化情况的是B.
3为恒容绝热容器,进行上述反应,起始与平衡时的各物质的量见下表:
若在达到平衡后的容器丙中,分别按照下列A、B、C三种情况继续添加各物质,则再次达平衡时,容器丙中H2的百分含量按由大到小的顺序B>C>A(用A、B、C表示).
Ⅲ.25℃时,Fe(OH)3的ksp=4ⅹ10-38,现有盐酸酸化的0.08mol/L的FeCl3溶液,其PH=1,向其中加入等体积的0.05mol/L的NaOH溶液,可恰好开始析出沉淀(混合时溶液体积可直接加和).
| N≡N | O=O | N-N | N-H | O-H | |
| 键能(KJ•mol-1) | 946 | 497 | 154 | 391 | 463 |
Ⅱ.密闭容器中进行反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H<02反应的化学平衡表达式为K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:600℃时,上述反应的平衡常数K=16.现有如图1甲(恒温恒压)和如图1乙(恒温恒容)两容器,起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
| 乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |

①关于甲、乙容器,下列说法正确的是AB
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4 ,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=0.05mol/(L•min-1)
③平衡后若将乙容器体系温度突然降低100℃,如图2下述图象中能正确反映平衡移动过程中容器内变化情况的是B.
3为恒容绝热容器,进行上述反应,起始与平衡时的各物质的量见下表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 3.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 3.0 | 0 | 0 |
| B/mol | 0 | 0 | 3.0 | 3.0 |
| C/mol | m | n | p | q |
13.下列方程式书写正确的是( )
| A. | NaHCO3溶液的电离:NaHCO3═Na++HCO3- | |
| B. | 氯化铵溶液的水解:NH4++H2O═NH3•H2O+H+ | |
| C. | 碳酸钠的水解:CO32-+2H2O═H2CO3+2OH- | |
| D. | 氯化铝和碳酸钠溶液混合:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2 |
10.下列变化过程中,△S<0的是( )
| A. | 氯化钠溶于水中 | B. | NH3(g)与HCl(g)反应生成NH4Cl(s) | ||
| C. | 干冰(CO2)的升华 | D. | CaCO3(s)分解为CaO(s)和CO2(g) |
11.碱性电池具有容量大、放电电流大的特点,得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+MnO2(s)+H2O(l)═ZnO (s)+Mn(OH)2 (s),下列说法错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池工作时,电子由正极通过外电路流向负极 | |
| C. | 电池正极的电极反应式为:MnO2(s)+2H2O(1)+2e-═Mn(OH)2 (s)+2OH-(aq) | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
 (1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6kJ热量,写出表示CH4的燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.
(1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6kJ热量,写出表示CH4的燃烧热的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.