��Ŀ����
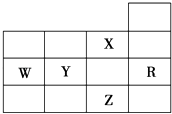
����Ŀ��ij��ȤС����ȡ��������������������ʵ�飬��װ����ͼ��ʾ����ش��������⣺ 
��1������A�������� �� ʵ�����Ʊ������ķ�Ӧ����ʽΪ ��
��2��C�з�����Ӧ�Ļ�ѧ����ʽΪ �� �����������ɫ��������C�У��۲쵽�������� �� ԭ���� ��
��3��ʵ���й۲쵽D��Һ����ɫ�������ϵ�֪���۵⻯����Һ�ǵ��ۺ͵⻯�أ�KI���Ļ����Һ��д��Dװ���з�����Ӧ�����ӷ���ʽ ��
��4��F�����������۷�Ӧ�Ʊ���ˮ���Ȼ�����������֪�û�������غ�ɫ������ˮ���⣬100������ʱ������˫ͨ��F�в�����ά�������뷴Ӧ��������������F��Hװ��֮�䰲װGװ�õ�Ŀ���� ��
��5��H��NaOH��Һ�������� ��
���𰸡�
��1����Һ©���� MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��2��Cl2+H2O=HCl+HClO����ɫ������ɫ���������Ƿ�Ӧ�����˴�����,���������ǿ������,�Ӷ�ʹ��ɫ������ɫ
��3��Cl2+2I��=I2+2Cl��
��4����ֹ�Ȼ�����������ĵ��ܣ���ֹH�е�ˮ��������F��,ʹ��ˮ���Ȼ�������
��5�����ն��������,��ֹ������Ⱦ
���������⣺��1������������״��֪����A�������Ƿ�Һ©����ʵ�����ü��ȶ���������Ũ������ȡ���������߷�Ӧ�����Ȼ��̡�������ˮ������ʽ��MnO2+4HCl�� Ũ�� ![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
���Դ��ǣ���Һ©����MnO2+4HCl�� Ũ�� ![]() MnCl2+Cl2��+2H2O����2��������ˮ��Ӧ��������ʹ����ᣬ����ʽ��Cl2+H2O=HCl+HClO�����������ǿ�����ԣ��Ӷ�ʹ��ɫ������ɫ�����������������ɫ��������C�У��۲쵽����������ɫ������ɫ��
MnCl2+Cl2��+2H2O����2��������ˮ��Ӧ��������ʹ����ᣬ����ʽ��Cl2+H2O=HCl+HClO�����������ǿ�����ԣ��Ӷ�ʹ��ɫ������ɫ�����������������ɫ��������C�У��۲쵽����������ɫ������ɫ��
���Դ��ǣ�Cl2+H2O=HCl+HClO����ɫ������ɫ���������Ƿ�Ӧ�����˴����ᣬ���������ǿ�����ԣ��Ӷ�ʹ��ɫ������ɫ����3������������ǿ�ڵⵥ�ʣ�����������ӷ���������ԭ��Ӧ���ɵ�������ӣ����������۱��������ӷ���ʽ��Cl2+2I��=I2+2Cl����
���Դ��ǣ�Cl2+2I��=I2+2Cl������4��˫ͨ��F�в�����ά�������뷴Ӧ���������Ƿ�ֹ�Ȼ�����������ĵ��ܣ��Ȼ�������ˮ���⣬����Ӧ��F��Hװ��֮�䰲װGװ�ã�
���Դ��ǣ���ֹ�Ȼ�����������ĵ��ܣ���ֹH�е�ˮ��������F�У�ʹ��ˮ���Ȼ������⣻��5�������ж�ֱ���ŷ��ܹ�������Ⱦ�������ܹ����������Ʒ�Ӧ��H��NaOH��Һ�����������ն������������ֹ������Ⱦ��
���Դ��ǣ����ն������������ֹ������Ⱦ��
�����㾫�����������⣬������Ҫ�˽�������ʵ�����Ʒ�(ʵ�����Ʒ���MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O)��

 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д�