题目内容
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要. 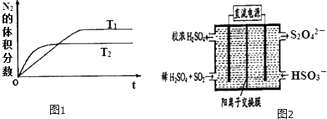
(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2═2NO,是导致汽车尾气中含有NO的原因之一,科学家设计利用NH3在催化条件下将NOx还原成N2而排放.
①在T1、T2温度下,一定量的NH3发生分解反应时N2的体积分数随时间变化如图1所示,根据图象判断反应N2(g)+3H2(g)═2NH3(g)的△H0(填“>”或“<”).
②在T3温度下,向2L密闭容器中充入10molN2与5mo1H2 , 50秒后达到平衡,测得NH3的物质的量为2mol,则该反应的速率v(N2) . 该温度下,若增大压强此反应的平衡常数将(填“增大”、“减小”、“不变”或“无法确定”);若开始时向上述容器中充入N2与H2均为10mol,则达到平衡后H2的转化率将 . (填“升高”、“降低”)
(2)利用图2所示装置(电极均为惰性电极)可吸收SO2 , 用阴极排出的溶液可吸收NO2 .
①阳极的电极反应式为 .
②在碱性条件下,用阴极排出的溶液吸收NO2 , 使其转化为无害气体,同时有SO32﹣生成.该反应的离子方程式为 .
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a molL﹣1的醋酸与b mol﹣L﹣1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO﹣),则该混合溶液中醋酸的电离常数Ka=(用含a和b的代数式表示).
【答案】
(1)>;0.01mol?L﹣1?s﹣1;不变;降低
(2)SO2+2H2O﹣2e﹣═SO42﹣+4H+;4S2O42﹣+2NO2+8OH﹣═8SO42﹣+N2+4H2O
(3)![]() ×10﹣7L/mol
×10﹣7L/mol
【解析】解:(1)①根据图象判断,T2曲线先到达平衡,反应速率大,温度较高,而温度升高,氮气的体积分数减小,说明升高温度平衡向正反应移动,升高温度向吸热方向进行,故正反应为吸热反应,△H>0.所以答案是:>;②v(NO)= ![]() =
= ![]() =0.02 molL﹣1s﹣1 , v(N2):v(NO)=1:2,所以v(N2)=0.01molL﹣1s﹣1;因为平衡常数仅与温度有关,所以
=0.02 molL﹣1s﹣1 , v(N2):v(NO)=1:2,所以v(N2)=0.01molL﹣1s﹣1;因为平衡常数仅与温度有关,所以
若增大压强此反应的平衡常数将不变;若开始时向上述容器中充入N2与H2均为10mol,相对于在原平衡的基础上在充H25mol,虽然平衡正向移动,但达到平衡后H2的转化率将降低,所以答案是:0.01molL﹣1s﹣1;不变;降低;(2)①依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极区发生反应SO2﹣2e﹣+2H2O═SO42﹣+4H+;
所以答案是:SO2+2H2O﹣2e﹣=SO32﹣+4H+;②阴极排出的溶液为S2O42﹣ , 二氧化氮与其发生反应,S2O42﹣中硫元素由+3价,变为硫酸根中硫元素为+4价,S2O42﹣被氧化是还原剂;二氧化氮中的氮元素化合价为+4价变为氮气0价,二氧化氮被还原为氧化剂,依据原子守恒和得失电子守恒可得,发生的离子方程式为4S2O42﹣+2NO2+8OH﹣═8SO42﹣+N2+4H2O,所以答案是:4S2O42﹣+2NO2+8OH﹣═8SO42﹣+N2+4H2O;(3)反应平衡时,2c(Ba2+)=c(CH3COO﹣)=bmol/L,据电荷守恒,溶液中c(H+)=c(OH﹣)=10﹣7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K= ![]() =
= ![]() =
= ![]() ×10﹣7L/mol;
×10﹣7L/mol;
用含a和b的代数式表示该混合溶液中醋酸的电离常数为 ![]() ×10﹣7L/mol,
×10﹣7L/mol,
所以答案是: ![]() ×10﹣7L/mol.
×10﹣7L/mol.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对弱电解质在水溶液中的电离平衡的理解,了解当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.

