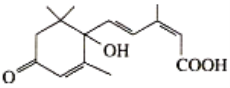
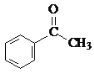
题目内容
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。
请回答下列问题:
(1)X、Y的元素符号依次是 _________、_________。
(2)XZ2与YZ2分子的立体构型分别是______________和_______________,相同条件下两者在水中的溶解度较大的是____________(写分子式)。
(3)Q的元素名称是_________,它在元素周期表中的位置是_________________,它的核外电子排布式为____________________,在形成化合物时它的最高化合价为___________。
(4)Y、Z、E三种元素原子的第一电离能由大到小的顺序是____________。(用元素符号表示)
【答案】S C V形 直线型 SO2 铬 第四周期VIB族 1s22s22p63s23p63d54s1或[Ar]3d54s1 +6 F>O>C
【解析】
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,则X为S元素;Y原子核外的L层电子数是K层的两倍,为C元素;Z是地壳内含量(质量分数)最高的元素,为O元素;Q的核电荷数是X与Z的核电荷数之和,为Cr元素;E在元素周期表的各元素中电负性最大,为F元素。
由分析知:X为S元素、Y为C元素、Z为O元素、Q为Cr元素、E为F元素;
(1)X、Y的元素符号依次是S、C;
(2) XZ2与YZ2分子分别是SO2与CO2分子,SO2分子中S原子价层电子对个数是2+![]() =3,其中含有1个孤电子对,则为sp2杂化,立体构型是V形;CO2分子中C原子价层电子对个数是2+
=3,其中含有1个孤电子对,则为sp2杂化,立体构型是V形;CO2分子中C原子价层电子对个数是2+![]() =2,不含孤电子对,则为sp杂化,立体构型是直线形;SO2是极性分子,CO2是非极性分子,根据相似相溶原理可知SO2在水中溶解度较大;
=2,不含孤电子对,则为sp杂化,立体构型是直线形;SO2是极性分子,CO2是非极性分子,根据相似相溶原理可知SO2在水中溶解度较大;
(3) Q为铬元素,位于第四周期第VIB族;其原子核外有24个电子,根据构造原理该原子核外电子排布式为1s22s22p63s23p63d54s1,价电子排布式为3d54s1,则在形成化合物时它的最高化合价为+6价;
(4)C、O、F为同周期主族元素,随核电荷数增大,元素原子的第一电离能呈增大趋势,则三种元素原子的第一电离能由大到小的顺序是F>O>C。

 名校课堂系列答案
名校课堂系列答案【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如右下表。下列有关说法正确的是( )
溶质 | pH |
NaF | 7.5 |
Na2CO3 | 11.6 |
NaClO | 9.7 |
NaHCO3 | 8.3 |
A. 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数为1×10-13
HF+OH-的平衡常数为1×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-)