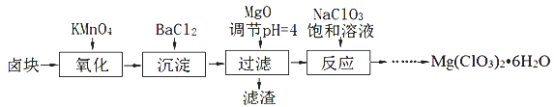
题目内容
【题目】下列化学反应能设计成原电池的是( )
A.CaCO3+2HCl═CaCl2+H2O+CO2↑B.BaCl2+Na2SO4═2NaCl+BaSO4↓
C.2NaOH+CO2═Na2CO3+H2OD.Fe+CuCl2═FeCl2+Cu
【答案】D
【解析】
能设计成原电池的反应必须是氧化还原反应,反应中有元素化合价变化的反应时氧化还原反应,上述反应中只有反应Fe+CuCl2═FeCl2+Cu属于氧化还原反应,故D正确。
故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂。

下列关于实验现象的解释或结论正确的是
选项 | 实验现象 | 解释或结论 |
A | a中无明显现象 | Na2SO3和H2O2一定不发生反应 |
B | b中加稀H2SO4后才产生淡黄色沉淀 | SO32和S2两种离子一定不能大量共存 |
C | c中加BaCl2溶液后产生白色沉淀且红色褪去 | Ba2++ SO32 == BaSO3↓,使SO32水解平衡逆向移动,红色褪去 |
D | d中产生白色沉淀 | 原Na2SO3溶液中含有SO42 |
A. A B. B C. C D. D
【题目】如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是
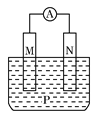
M | N | P | |
A | Zn | Cu | 稀H2SO4溶液 |
B | Cu | Fe | 稀HCl溶液 |
C | Ag | Zn | AgNO3溶液 |
D | Zn | Fe | Fe(NO3)3溶液 |
A. A B. B C. C D. D