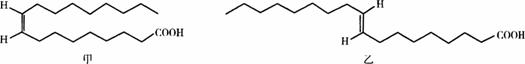
��Ŀ����
(15��)��ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص������Լ���ǩ�ϵIJ������ݡ�

��.�������A-D��ʾ�����ʣ����¹�����Ҫ������Ũ�������Щ���ʣ��뽫ѡ����ĸ�������и�С��������ڣ�
Aǿ���� B ��ˮ�� C ��ˮ�� D ǿ������
��1��Ũ������Ը��������� ��
��2��Ũ����ʹľ����ڣ� ��
��3���ȵ�Ũ������ͭƬ��Ӧ�� ��
�����ø�Ũ��������100 mL��1 mol/L��ϡ���ᡣ�ɹ�ѡ�õ������У��ٽ�ͷ�ιܣ�����ƿ�����ձ����� ҩ�ף�����Ͳ����������ƽ��
��ش��������⣺
(1)����ϡ����ʱ�����������в���Ҫʹ�õ��� ��ѡ����ţ�����ȱ�ٵ�������
���� ��д�������ƣ���
(2)�����㣬����100mL1mol/L��ϡ������Ҫ����Ͳ��ȡ����Ũ��������Ϊ �� mL������һλС��������ȡŨ����ʱӦѡ�� ��ѡ���10mL����50mL ����100mL��������Ͳ��
(15��)��. (ÿ��2��) B �� C ��A D
��(1) (ÿ��2��) �� �� �� �� 100mL����ƿ ������
(2) 5.4��3�֣����٣�2�֣�
��������

 ����ѧ����ϵ�д�
����ѧ����ϵ�д�(15��) ��Դ��ȱ������������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦI�� CO(g) �� 2H2(g)  CH3OH(g) ��H1
CH3OH(g) ��H1
��ӦII�� CO2(g) �� 3H2(g)  CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ����� ���I������
���±����������Ƿ�ӦI�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�ɱ�����
 ���жϦ�H1 0 ����������������������� [��Դ:ѧ���ơ���]
���жϦ�H1 0 ����������������������� [��Դ:ѧ���ơ���]��ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)�� 0.2 mol��L����CO��ת����Ϊ ��
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H ����1275.6 kJ��mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H ����566.0 kJ��mol
�� H2O(g) �� H2O(l) ��H ����44.0 kJ��mol
�����1 mol�״�����ȫȼ������1 molһ����̼��Һ̬ˮ�ų�������Ϊ ��
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ�����������ͼ��ʾ�ĵ��װ�á�
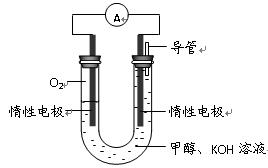
�ٸõ�������ĵ缫��ӦΪ ��
�ڹ���һ��ʱ������Һ��pH��С���õ���ܷ�Ӧ�Ļ�ѧ����ʽΪ
��
(15��) ��Դ��ȱ������������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦI��
CO(g) �� 2H2(g)  CH3OH(g) ��H1
CH3OH(g) ��H1
��ӦII��
CO2(g) �� 3H2(g)  CH3OH(g) + H2O(g)
��H2
CH3OH(g) + H2O(g)
��H2
�� ������Ӧ���ϡ�ԭ�Ӿ��á�ԭ����� ���I������
�� �±����������Ƿ�ӦI�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
|
�¶� |
250�� |
300�� |
350�� |
|
K |
2.041 |
0.270 |
0.012 |
�ɱ��������жϦ�H1 0 ����������������������� [��Դ:ѧ���ơ���]
�� ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)�� 0.2 mol��L����CO��ת����Ϊ ��
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H �� ��1275.6 kJ��mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H �� ��566.0 kJ��mol
�� H2O(g) �� H2O(l) ��H �� ��44.0 kJ��mol
�����1 mol�״�����ȫȼ������1 molһ����̼��Һ̬ˮ�ų�������Ϊ ��
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ�����������ͼ��ʾ�ĵ��װ�á�
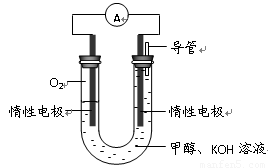
�ٸõ�������ĵ缫��ӦΪ ��
�ڹ���һ��ʱ������Һ��pH��С���õ���ܷ�Ӧ�Ļ�ѧ����ʽΪ
��