题目内容
某课外小组研究铝土矿中Al2O3的含量.查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等.从铝土矿中提取Al2O3的过程如下: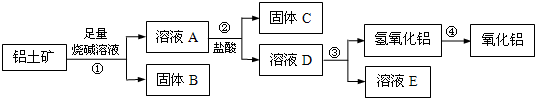
(1)固体B的主要用途有(写出1条即可):______.
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是:
______;
______;
第③步中,生成氢氧化铝的化学方程式是:______.
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是:______.(保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是______.

(1)固体B的主要用途有(写出1条即可):______.
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是:
______;
______;
第③步中,生成氢氧化铝的化学方程式是:______.
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是:______.(保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是______.
(1)向铝土矿中加入足量烧碱溶液后,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁,氧化铁可作为炼铁的原料,氧化铁为红色,可用作涂料、油漆等,
故答案为:炼铁原料、用作涂料、油漆等;
(2)根据框图流程,向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物,既溶液强酸又溶于强碱.只Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁氧化铁和氢氧化钠溶液不反应,
则向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O,
固体B是氧化铁,A中含有偏铝酸钠和硅酸钠以及过量的氢氧化钠,则加入过量的盐酸后生成硅酸沉淀和氯化铝,发生反应的离子方程式是SiO2+2OH-=SiO32-+H2O,
即固体C是硅酸,D中含有氯化铝和盐酸,因此反应③中生成氢氧化铝的试剂是氨气或氨水,则生成氢氧化铝的方程式是AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl,
故答案为:Al2O3+2OH-=2AlO2-+H2O;SiO2+2OH-=SiO32-+H2O;AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl;
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,说明所得氢氧化铝固体的质量与原铝土矿质量相等,即铝土矿中Al2O3的质量分数和氢氧化铝中氧化铝的质量分数是相同的.又因为氧化铝可以写成Al2O3?3H2O的形式,所以质量分数是
×100%=65.4%,
故答案为:65.4%;
(4)Cl2有强氧化性,碳具有还原性,每消耗0.5 mol 碳单质,转移1mol电子,这说明反应中碳失去2个电子,即氧化产物是CO,所以反应的化学方程式是Al2O3+3Cl2+3C
2AlCl3+3CO,
故答案为:Al2O3+3Cl2+3C
2AlCl3+3CO;
故答案为:炼铁原料、用作涂料、油漆等;
(2)根据框图流程,向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物,既溶液强酸又溶于强碱.只Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁氧化铁和氢氧化钠溶液不反应,
则向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O,
固体B是氧化铁,A中含有偏铝酸钠和硅酸钠以及过量的氢氧化钠,则加入过量的盐酸后生成硅酸沉淀和氯化铝,发生反应的离子方程式是SiO2+2OH-=SiO32-+H2O,
即固体C是硅酸,D中含有氯化铝和盐酸,因此反应③中生成氢氧化铝的试剂是氨气或氨水,则生成氢氧化铝的方程式是AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl,
故答案为:Al2O3+2OH-=2AlO2-+H2O;SiO2+2OH-=SiO32-+H2O;AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl;
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,说明所得氢氧化铝固体的质量与原铝土矿质量相等,即铝土矿中Al2O3的质量分数和氢氧化铝中氧化铝的质量分数是相同的.又因为氧化铝可以写成Al2O3?3H2O的形式,所以质量分数是
| 102 |
| 102+54 |
故答案为:65.4%;
(4)Cl2有强氧化性,碳具有还原性,每消耗0.5 mol 碳单质,转移1mol电子,这说明反应中碳失去2个电子,即氧化产物是CO,所以反应的化学方程式是Al2O3+3Cl2+3C
| ||
故答案为:Al2O3+3Cl2+3C
| ||

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目