题目内容
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
COCl2的分解反应为COCl2(g)  Cl2(g) + CO(g) △H = + 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14
min的COCl2浓度变化曲线未画出):
Cl2(g) + CO(g) △H = + 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14
min的COCl2浓度变化曲线未画出):

(1) 计算反应在第8 min 时的平衡常数K = ;
(2) 比较第2 min 反应温度T(2)与第8 min反应温度T(8)的高低:T(2) T(8)(填“<”、“>”或“=”);
(3) 若12 min 时反应于温度T(8)下重新达到平衡,则此时c(COCl2) = mol·l-1;
(4) 比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小 ;
(5)比较反应物COCl2在5~6 min和15~16 min时平均反应速率的大小v(5~6) v(12~13) (填“<”、“>”或“=”),原因是 。
. (1)0.234mol·L-1 (2)< (3)0.031 (4)v(5-6)>v(2-3)=v(12-13) (5)> 在相同温度时,该反应的反应物浓度越高,反应速率越大
【解析】(1)根据图像可知,反应在第8 min 时光气、CO和氯气的平衡浓度分别是(mol/L)0.04、0.085、0.11,所以此时平衡常数K= 。
。
(2)反应在第2 min 时光气、CO和氯气的平衡浓度分别是(mol/L)0.055、0.07、0.095,所以此时平衡常数K=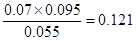 <0.234。K值很明显小于T(8)时的K值,由于正反应是吸热反应,所以T(2)小于T(8),即升高温度平衡向正反应方向进行,平衡常数增大。
<0.234。K值很明显小于T(8)时的K值,由于正反应是吸热反应,所以T(2)小于T(8),即升高温度平衡向正反应方向进行,平衡常数增大。
(3)由于题目说了是不同条件下的平衡状态,那么后面温度就不会改变,所以K值不变。此时CO和氯气的浓度分别是0.06mol/L和0.12mol/L,所以c(COCl2)=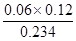 =0.031molL。
=0.031molL。
(4)因为5-6分钟,CO浓度在改变所以平均反应速率大于其它的,因为处于平衡状态,根据V的计算公式,2-3、12-13的平均反应速率为0,即v(5-6)>v(2-3)=v(12-13)。
(5)因为随着反应的进行,反应物的浓度是逐渐降低的。由于在相同温度时,反应的反应物浓度越高,反应速率越大,所以5-6分钟时浓度改变大于12-13时浓度的改变。


 Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):
Cl2(g) + CO(g) △H =" +" 108 KJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如大图(每次仅改变一个条件):


 Cl2(g) + CO(g) △H
= +108 kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线来示出):
Cl2(g) + CO(g) △H
= +108 kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线来示出):