题目内容
一定温度下,在固定体积的密闭容器中发生可逆反应 A(s)+2B(g) 2C(g) ,下列叙述中是反应达到平衡的标志的是( )
2C(g) ,下列叙述中是反应达到平衡的标志的是( )
(1)v正(A)=2v逆(C);(2)单位时间生成amol A,同时生成2amol B;(3)A、B、C的浓度不再变化;(4)混合气体的平均摩尔质量不再变化(5)混合气体的总压强不再变化;(6)A、B、C的分子数目比为1:3:2。
A.(1)(3)(4) B.(3)(4) C.(2)(3)(5) D.(3)(4)(5)(6)
 2C(g) ,下列叙述中是反应达到平衡的标志的是( )
2C(g) ,下列叙述中是反应达到平衡的标志的是( )(1)v正(A)=2v逆(C);(2)单位时间生成amol A,同时生成2amol B;(3)A、B、C的浓度不再变化;(4)混合气体的平均摩尔质量不再变化(5)混合气体的总压强不再变化;(6)A、B、C的分子数目比为1:3:2。
A.(1)(3)(4) B.(3)(4) C.(2)(3)(5) D.(3)(4)(5)(6)
B
可逆反应达到平衡的本质是:正反应速率与逆反应速率相等、混合体系中各组分的浓度保持不变;所以
(1)错,因A为固体,不能用于比较速率的大小;(2)错,单位时间生成amol A,同时生成2amol B,为每时每刻都这样反应;(3)正确,A、B、C的浓度不再变化;(4)正确,混合气体的平均摩尔质量不再变化;(5)错,该反应为等体积反应,无论平衡与否体系内总压强均不变;(6)错,平衡与否与A、B、C的分子数目比为1:3:2无关;
(1)错,因A为固体,不能用于比较速率的大小;(2)错,单位时间生成amol A,同时生成2amol B,为每时每刻都这样反应;(3)正确,A、B、C的浓度不再变化;(4)正确,混合气体的平均摩尔质量不再变化;(5)错,该反应为等体积反应,无论平衡与否体系内总压强均不变;(6)错,平衡与否与A、B、C的分子数目比为1:3:2无关;

练习册系列答案
相关题目
 2NO2(g),当测得N2O4转化率为33.3%时,混合气体平均式量是 ( )
2NO2(g),当测得N2O4转化率为33.3%时,混合气体平均式量是 ( ) CO2(g)+H2(g)。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2(g)+H2(g)。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( ) C分别在三种不同实验条件下进行,它们的起始浓度分别为c(A)=0.100mol/L,c(B)=0.200mol/L,c(C)=0.000mol/L。反应物A浓度随时间变化如图所示。
C分别在三种不同实验条件下进行,它们的起始浓度分别为c(A)=0.100mol/L,c(B)=0.200mol/L,c(C)=0.000mol/L。反应物A浓度随时间变化如图所示。
 ①条件下达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。若降温时,请把反应速度变化情况画在图中a~b处。
①条件下达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。若降温时,请把反应速度变化情况画在图中a~b处。
 O(g)+O2(g)
O(g)+O2(g)  2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表: 该反应的平均速率v= . mol/(L·s)
该反应的平均速率v= . mol/(L·s)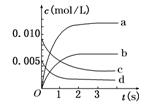
 、Y、Z表示元素符号)。讨论上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH。试填写表中空白(要求填写有关粒子化学式):
、Y、Z表示元素符号)。讨论上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH。试填写表中空白(要求填写有关粒子化学式): 2 SO3(g) △H =" —196.0" kJ.mol-1
2 SO3(g) △H =" —196.0" kJ.mol-1 使用过量SO2
使用过量SO2