题目内容
下列叙述中,正确的是
A.含金属元素的离子一定都是阳离子
B.现代化学分析测试中,常借助一些仪器来分析化学物质组成。例如,可用元素分析仪确定C、H、O等元素,用红外光谱仪确定物质中的有机原子团,用原子吸收光谱确定物质中含有哪些非金属元素
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
A.含金属元素的离子一定都是阳离子
B.现代化学分析测试中,常借助一些仪器来分析化学物质组成。例如,可用元素分析仪确定C、H、O等元素,用红外光谱仪确定物质中的有机原子团,用原子吸收光谱确定物质中含有哪些非金属元素
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
D
试题分析:A、部分含金属元素的离子为阴离子,如MnO4?、AlO2?等,错误;B、原子吸收光谱也可以确定物质含有的金属元素,错误;C、某元素从化合态变为游离态,若化合态时为正价被还原,若化合态时为负极被氧化,错误;D、如Fe3+离子可被弱还原剂还原为Fe2+,正确。

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
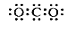
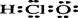
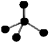
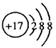

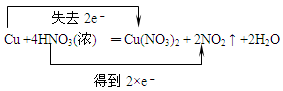

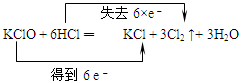



 C
C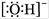
 和
和 互为同系物
互为同系物
 2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+
2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为 。原因是 。
Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为 。原因是 。
 Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq) 2CrO42-+2H+
2CrO42-+2H+ 2Al+Fe2O3
2Al+Fe2O3