��Ŀ����
±��Ԫ�صĵ�������H2��Ӧ
H2+F2=2HF | �ڰ����ܾ��һ��ϲ�������ը |
H2+Cl2=2HCl | ���ջ��ȼ������Ӧ |
H2+Br2=2HBr | ������һ���¶Ȳ��ܷ�Ӧ |
H2+I2=2HI | ���ϼ��Ȳ��ܻ�����Ӧ�����ɵ�HI��ֽ� |
��1��±��Ԫ��λ�����ڱ��е�______________�塣
��2���õ���ʽ��ʾHCl���γɹ���______________��
��3�������ϱ��������Ʋ��������ԭ�������ĵ�����___________������ĸ����
a. ���ʵ��۷е������� b. Ԫ�صķǽ���������
c. ±����Ļ�ԭ�����μ��� d. ±������ȶ������μ���
��4����ͬ±��ԭ��֮����γ�±�ػ������������±�ص��������д��BrCl��SO2��ˮ��Һ�з�����Ӧ�Ļ�ѧ����ʽ___________��
��C1��ѧ����ָ��̼���ʻ�����к�1��̼ԭ�ӵ����ʣ���CO��CO2��CH4��CH3OH�ȣ�Ϊԭ�Ϻϳɹ�ҵ��Ʒ�Ļ�ѧ���գ��Կ�������Դ�Ϳ��ƻ�����Ⱦ����Ҫ���塣
��1��һ���¶��£��������ݻ���Ϊ2 L���ܱ������У��ֱ�����Ӧ��
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ��H=��49.0kJ/mol������������£�
CH3OH(g)+H2O(g) ��H=��49.0kJ/mol������������£�
���� | �� | �� |
��Ӧ��Ͷ���� | 1 mol CO2(g)��3 mol H2(g) | 1 mol CH3OH(g)��1 mol H2O(g) |
ƽ��ʱc(CH3OH) | c1 | c2 |
ƽ��ʱ�����仯 | �ų�29.4 kJ | ����a kJ |
��ش�
��c1 c2���>������<����=������a = ��
�������з�Ӧ10 sʱ�ﵽƽ�⣬����CO2����ʾ���з�Ӧ�ӿ�ʼ��ƽ������е�ƽ����Ӧ������ mol/(L��s)��
��2��ѹǿΪp1ʱ �������Ϊ1 L���ܱ������г���b mol CO��2b mol H2��������ӦCO(g)+2H2(g) CH3OH(g)��ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����ش�
CH3OH(g)��ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����ش�
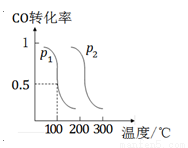
�ٸ÷�Ӧ���� ��������š����ȷ�Ӧ��p1 p2�����������������������
��100��ʱ���÷�Ӧ��ƽ�ⳣ��K= ���ú�b�Ĵ���ʽ��ʾ����
��3����������β���ķ�Ӧ��2NO(g)+2CO(g)?2CO2(g)+N2(g) ��H<0���ں��º��ݵ��ܱ�������ͨ��n(NO):n(CO)=1:2�Ļ�����壬����������Ӧ������ͼ����ȷ����˵����Ӧ�ڽ��е�t1ʱ��һ���ﵽƽ��״̬���� ��ѡ����ĸ����

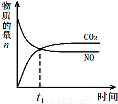
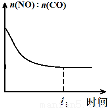
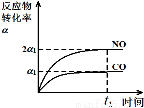
a b c d
4�ֶ�����Ԫ��X��Y��Z��W��ԭ�����������������ݱ�����Ϣ�жϣ�����˵������ȷ����
Ԫ�� | X | Y | Z | W |
��� | �����ֳ����ĵ� | ��������ԭ�Ӱ� | �ؿ��к������ | ������������ |
A��Y�ĵ���ȼ�ջ���ʻ�ɫ
B��4��Ԫ�صļ����Ӱ뾶��С����Z
C��X��Y�γɵĻ�����ֻ�������Ӽ�
D��Y��Z��W������������Ӧ��ˮ��������֮����ܷ�Ӧ


 ��ϵͳ����Ϊ2������2���һ�����
��ϵͳ����Ϊ2������2���һ����� ˫��
˫�� ��ͨ�������SO2���壬��Һ�����ɫ��������˵����ȷ���ǣ� ��
��ͨ�������SO2���壬��Һ�����ɫ��������˵����ȷ���ǣ� �� ɫ��������SO2��Ư����
ɫ��������SO2��Ư���� CuS(s)+Zn2+
CuS(s)+Zn2+ оƬ�ϼ���10�ڸ�����ܣ��书��Զ�����������Ҫ��ö࣬��Թ�Ĵ���Ҫ��ܸߡ��û�ѧ�������Ƶøߴ��ȹ裬�仯ѧ����ʽΪ��
оƬ�ϼ���10�ڸ�����ܣ��书��Զ�����������Ҫ��ö࣬��Թ�Ĵ���Ҫ��ܸߡ��û�ѧ�������Ƶøߴ��ȹ裬�仯ѧ����ʽΪ�� Si��2CO��
Si��2CO�� SiCl4
SiCl4 Si��4HCl�����У���Ӧ�ٺ͢�����
Si��4HCl�����У���Ӧ�ٺ͢�����