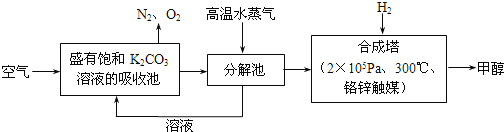
题目内容
【题目】在容积为2L的容器内,发生反应2A(s)+3B(g) ![]() 2C(g)+D(g),起始时充入3molA和2.5molB混合气体;经过5min生成0.5molD,下列说法正确的是
2C(g)+D(g),起始时充入3molA和2.5molB混合气体;经过5min生成0.5molD,下列说法正确的是
A.若单位时间内生成的B和D的物质的量之比为3:1,则体系处于平衡状态
B.C的平衡浓度为2mol/L
C.5min内B的平均消耗速率为0.3mol/(L·min)
D.平衡后,增大压强,平衡向正反应方向移动
【答案】A
【解析】
试题分析:A、生成B为逆反应速率,生成D为正反应速率,当二者的比值等于计量数之比即是平衡状态,故A正确;B、起始时充入3molA和2.5molB混合气体;经过5min生成0.5molD,
2A(s)+3B(g)![]() 2C(g)+D(g),
2C(g)+D(g),
起始量(mol) 3 2.5 0 0
变化量(mol) 1 1.5 1 0.5
5min时(mol) 2 1 1 0.5
5min时 c(C)=0.5mol/L,平衡时浓度无法确定,故B错误;C、参加反应的B为1.5mol,所以v(B)=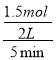 =0.15mol/(Lmin),故C错误;D、反应前后气体的体积不变,增大压强平衡不移动,故D错误;故选A。
=0.15mol/(Lmin),故C错误;D、反应前后气体的体积不变,增大压强平衡不移动,故D错误;故选A。

练习册系列答案
相关题目