题目内容
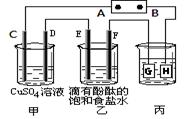
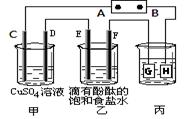
某小组同学用下图装置进行实验研究(a、b、c表示止水夹).请评价或完善其方案: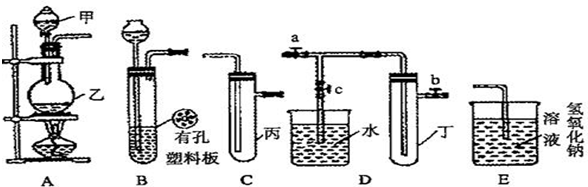
(1)用MnO2和浓盐酸制取氯气,将A、C、E相连,A中反应的离子方程式
在丙中加入适量水可制得氯水.将所得氯水分成两份,进行实验,其操作、现象、结论为:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
②实验II 推出的相应结论是否合理?
(2)为比较Cl2和I2的氧化性强弱,将A、C、E相连,C中盛的试剂可以为
(3)将B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.
①B中发生反应的离子方程式为
②若关闭止水夹a、b,打开c,双手紧握(或微热)试管丁,使其中的NO2逸出进入D中,丁中可以观察到的现象
分析:(1)A中二氧化锰和浓盐酸反应制取氯气,据此写出反应的化学方程式;根据氯气有毒,氯气能够与氢氧化钠溶液反应分析;
①验证氯气与水反应的产物具有漂白性应首先排除干燥氯气的影响,需要进行对比实验;
②制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡;
(2)A、C、E相连即为二氧化锰和浓盐酸反应制取氯气,氯气的氧化性强于溴,氯气可以将溴从其盐溶液中置换出来;
(3)①B中铜与浓硝酸反应生成了二氧化氮气体,据此写出反应的离子方程式;
②根据气体受热体积膨胀及二氧化氮与水反应导致气体体积减小分析.
①验证氯气与水反应的产物具有漂白性应首先排除干燥氯气的影响,需要进行对比实验;
②制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡;
(2)A、C、E相连即为二氧化锰和浓盐酸反应制取氯气,氯气的氧化性强于溴,氯气可以将溴从其盐溶液中置换出来;
(3)①B中铜与浓硝酸反应生成了二氧化氮气体,据此写出反应的离子方程式;
②根据气体受热体积膨胀及二氧化氮与水反应导致气体体积减小分析.
解答:解:(1)A中二氧化锰与浓盐酸反应生成氯气、氯化锰和水,反应的离子方程式为:MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑;氯气有毒,多于的氯气应该用氢氧化钠溶液吸收,
故答案为:MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑;吸收多于的氯气,防止氯气污染大气;
①没有事先证明干燥的氯气无漂白性,则不能证明氯气与水反应的产物是否具有漂白性,
故答案为:不合理;没有事先证明干燥的氯气无漂白性;
②浓盐酸易挥发,制取的氯气中含HCl能与NaHCO3反应产生气体,如要证明氯气与水反应的产物具有酸性,必须先除去HCl,可通入饱和食盐水除杂,
故答案为:不合理;制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡;
(2)氯气的氧化性强于溴,氯气可以将溴从其盐溶液中置换出来,涉及的反应为Cl2+2Br-═2Cl-+Br2,可用KBr或NaBr,
故答案为:KBr或NaBr;
(3)①B中铜与浓硝酸反应生成硝酸铜、二氧化氮和水,发生反应的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
②若关闭止水夹a、b,打开c,双手紧握(或微热)试管丁,使其中的NO2逸出进入D中,由于二氧化氮气体受热膨胀加入丁中,与水溶液发生了反应,所以D中气体颜色变浅;导管中气体体积减小,压强减小,有水溶液倒吸入丁中,
故答案为:D中气体的红棕色颜色变浅并有水溶液倒吸入丁中.
| ||
故答案为:MnO2+4H++2Cl-
| ||
①没有事先证明干燥的氯气无漂白性,则不能证明氯气与水反应的产物是否具有漂白性,
故答案为:不合理;没有事先证明干燥的氯气无漂白性;
②浓盐酸易挥发,制取的氯气中含HCl能与NaHCO3反应产生气体,如要证明氯气与水反应的产物具有酸性,必须先除去HCl,可通入饱和食盐水除杂,
故答案为:不合理;制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡;
(2)氯气的氧化性强于溴,氯气可以将溴从其盐溶液中置换出来,涉及的反应为Cl2+2Br-═2Cl-+Br2,可用KBr或NaBr,
故答案为:KBr或NaBr;
(3)①B中铜与浓硝酸反应生成硝酸铜、二氧化氮和水,发生反应的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
②若关闭止水夹a、b,打开c,双手紧握(或微热)试管丁,使其中的NO2逸出进入D中,由于二氧化氮气体受热膨胀加入丁中,与水溶液发生了反应,所以D中气体颜色变浅;导管中气体体积减小,压强减小,有水溶液倒吸入丁中,
故答案为:D中气体的红棕色颜色变浅并有水溶液倒吸入丁中.
点评:本题考查了氯气的实验室制法、氯气的化学性质,题目难度不大,注意掌握实验室制取氯气的反应原理及氯气的化学性质,试题侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.

练习册系列答案
相关题目

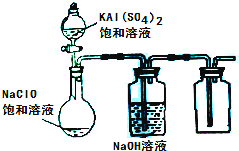 (2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
(2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.