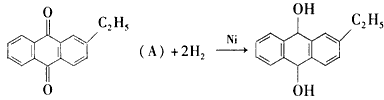题目内容
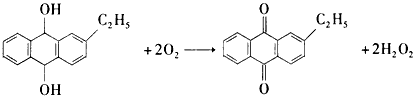
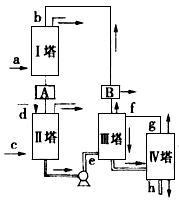
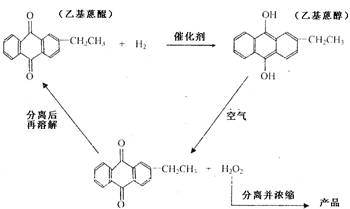
工业上用乙基蒽醌(A)制备H2O2,其工业流程可简单表示如下:
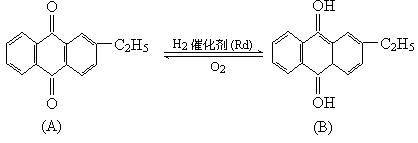
已知:A与H2、B与O2反应的物质的量之比均为1∶1.
(1)A的分子式为________,B的分子式为________.
(2)涉及氧化反应的化学方程式可写为:________;涉及还原反应的化学方程式可写为:________.
(3)“绿色化学”是当今社会人们提出的一个新概念,在绿色化学中,一个重要的衡量指标是原子的利用率,其计算公式为:
原子利用率=
例如:2CH2=CH2+O2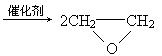 ,其原子利用率为100%,在“绿色化学”工艺中,此为理想状态,试问该法生产H2O2,可否称为理想状态的“绿色工艺”,简述理由:________________________________________________________.
,其原子利用率为100%,在“绿色化学”工艺中,此为理想状态,试问该法生产H2O2,可否称为理想状态的“绿色工艺”,简述理由:________________________________________________________.
答案:
解析:
解析:
|
(1)C16H12O2,C16H14O2;(2)C16H14O2+O2 |

练习册系列答案
相关题目
 C16H12O2+H2O2,C16H12O2+H2
C16H12O2+H2O2,C16H12O2+H2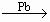 C16H14O2;(3)不可以,因为原子利用率未达到100%
C16H14O2;(3)不可以,因为原子利用率未达到100%