题目内容
13.某有机物A,气态时相对于同温同压下H2的密度为23.2.3g A完全燃烧时生成2.24L CO2(标准状况)和2.7g H2O.(1)求A的分子式(写出计算过程).
(2)写出A的所有可能的结构简式CH3CH2OH、CH3OCH3.
分析 (1)相对密度与相对分子质量成正比,据此可计算出A的相对分子质量;然后根据n=$\frac{V}{{V}_{m}}$、n=$\frac{m}{M}$分别计算出标况下2.24L二氧化碳、2.3gA、2.7g水的物质的量,再根据质量守恒定律计算出A的分子式;
(2)根据A的分子式及同分异构体的书写原则写出其可能的结构简式.
解答 解:(1)A的相对分子质量为23×2=46,则2.3gA的物质的量为:$\frac{2.3g}{46g/mol}$=0.05 mol,
2.7g水的物质的量为:$\frac{2.7g}{18g/mol}$=0.15mol,则A分子中含有H个数为:$\frac{0.15mol×2}{0.05mol}$=6,
标况下2.24L二氧化碳的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,A分子中含C个数为:$\frac{0.1mol}{0.05mol}$=2,
A分子中含有C、H的总原子量为:12×2+1×6=30<46,
所以A中含有氧元素,含有氧元素的数目为:$\frac{46-30}{16}$=1,
故该有机物的分子式为C2H6O,
答:A的分子式为C2H6O;
(2)分子式为C2H6O有机物,其H原子已经饱和,A可能为乙醇:CH3CH2OH,有可能为二甲醚:CH3OCH3,
故答案为:CH3CH2OH、CH3OCH3.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确相对密度与摩尔质量的关系为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.现有7瓶失去标签的液体,已知它们是有机试剂,可能是:①乙醇、②乙酸、③苯、④乙酸乙酯、⑤油脂、⑥葡萄糖溶液、⑦蔗糖溶液,现通过如下实验来确定各试剂瓶中所装的液体:
试给它们的试剂瓶重新贴上标签,其中:
A乙醇,C苯,E油脂,F葡萄糖,G蔗糖溶液.
| 实验步骤和方法 | 实验现象 |
| ①把7瓶液体分别依次标号A?B?C?D?E?F?G后,闻气味 | 只有F?G两种液体没有气味 |
| ②各取少量于试管中加水稀释 | 只有C?E?D三种液体不溶解而浮在水面上 |
| ③分别取少量7种液体于试管中加新 制Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取少量C?E?D于试管中,加稀NaOH 溶液并加热 | 只有C仍有分层现象,且在D的试管中闻 到特殊香味 |
A乙醇,C苯,E油脂,F葡萄糖,G蔗糖溶液.
1.试剂B、C分别是( )
| A. | NaOH、CuSO4 | B. | NaOH、新制Cu(OH)2 | C. | Na2CO3、CuSO4 | D. | H2SO4、新制Cu(OH)2 |
8.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L己烷中的分子数约为NA个 | |
| B. | 常温常压下,在18 g H218O中含有NA个水分子 | |
| C. | 标准状况下,15 g CH3CH3所含共价键数为3.5NA个 | |
| D. | 电解精炼铜时,若电路中转移的电子数为2NA个,则阳极质量减轻64 g |
18.下列有关问题,与盐的水解无关的是( )
| A. | 用盐酸除铁锈 | |
| B. | 用纯碱溶液清洗油污 | |
| C. | 加热蒸干AlCl3溶液得到Al(OH)3固体 | |
| D. | 实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 |
5.如图是某可逆反应在反应过程中的各物质的物质的量(v)与时间(t)的关系曲线.下列叙述正确的是( )
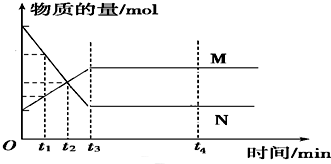

| A. | t1~t2时,只有正方向反应 | B. | t3~t4,反应不再发生 | ||
| C. | t3时,反应达到平衡 | D. | t3~t4,各物质的浓度相等 |
2.下列关于有机物的说法正确是( )
| A. | 乙烯、氯乙烯都属于不饱和烃 | |
| B. | 油脂、葡萄糖都能发生水解反应 | |
| C. | 乙酸、乙酸乙酯都不能与金属Na反应 | |
| D. | 苯能发生加成反应 |
4.常温下,将FeCl3溶液和KI溶液混合,发生如下反应:
2Fe3++2I-?2Fe2++I2
某研究小组为了证明FeCl3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5mL 0.1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液5~6滴,充分反应后溶液呈黄褐色,加入2mLCCl4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象.
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是上层溶液呈血红色,加入四氯化碳的作用是萃取碘单质,排除对后续实验颜色观察的干扰.
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe3+浓度过低.为此,甲又做了下列对比实验,实验结果记录如下:
分析实验记录,甲认为导致Fe3+浓度过低的原因是加入氯化铁的量过少,导致铁离子浓度过小;乙同学结合平衡移动的知识,认为还有一个原因是用四氯化碳萃取碘,促进平衡正向移动,导致铁离子浓度过小.
(3)现将反应2Fe3++2I-?2Fe2++I2设计成图所示的原电池
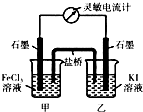
①能说明反应达到平衡的标志是ad(填序号).
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl2固体,此时甲(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为2Fe2+-2e-=2Fe3+.
2Fe3++2I-?2Fe2++I2
某研究小组为了证明FeCl3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5mL 0.1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液5~6滴,充分反应后溶液呈黄褐色,加入2mLCCl4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象.
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是上层溶液呈血红色,加入四氯化碳的作用是萃取碘单质,排除对后续实验颜色观察的干扰.
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe3+浓度过低.为此,甲又做了下列对比实验,实验结果记录如下:
| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2mL | 3mL | 4mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
(3)现将反应2Fe3++2I-?2Fe2++I2设计成图所示的原电池

①能说明反应达到平衡的标志是ad(填序号).
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl2固体,此时甲(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为2Fe2+-2e-=2Fe3+.