题目内容
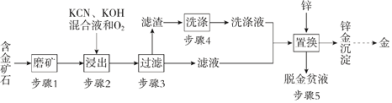
【题目】电解合成 1 , 2-二氯乙烷的实验装置如图所示。下列说法中正确的是

A. 该装置工作时,化学能转变为电能
B. CuCl2能将C2H4还原为 l , 2-二氯乙烷
C. X、Y依次为阳离子交换膜、阴离子交换膜
D. 该装置总反应为CH2CH2 + 2H2O + 2NaCl![]() H2 + 2NaOH + ClCH2CH2Cl
H2 + 2NaOH + ClCH2CH2Cl
【答案】D
【解析】
A. 该装置为外加电源的电解池原理;
B. 根据装置图易知,阳极生成的CuCl2与C2H4发生了氧化还原反应,根据化合价的升降判断该氧化还原反应的规律;
C. 根据电解池阴阳极发生的电极反应式及溶液电中性原则分析作答;
D. 根据具体的电解反应与氧化还原反应综合写出该装置的总反应。
A. 该装置为电解池,则工作时,电能转变为化学能,故A项错误;
B. C2H4中C元素化合价为-2价,ClCH2CH2Cl中C元素化合价为-1价,则CuCl2能将C2H4氧化为1,2一二氯乙烷,故B项错误;
C. 该电解池中,阳极发生的电极反应式为:CuCl - e- + Cl-= CuCl2,阳极区需要氯离子参与,则X为阴离子交换膜,而阴极区发生的电极反应式为:2H2O + 2e- = H2↑+ 2OH-,有阴离子生成,为保持电中性,需要电解质溶液中的钠离子,则Y为阳离子交换膜,故C项错误;
D. 该装置中发生阳极首先发生反应:CuCl - e- + Cl-= CuCl2,生成的CuCl2再继续与C2H4反应生成1,2一二氯乙烷和CuCl,在阳极区循环利用,而阴极水中的氢离子放电生成氢气,其总反应方程式为:CH2=CH2+2H2O+2NaCl![]() H2+2NaOH+ClCH2CH2Cl,故D项正确;
H2+2NaOH+ClCH2CH2Cl,故D项正确;
答案选D。

【题目】下述实验不能达到预期实验目的是( )
序号 | 实验内容 | 实验目的 |
A | 将2.5gCuSO4.5H2O溶解在97.5g水中 | 配制质量分数为1.6%的CuSO4溶液 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 室温下,用pH试纸测定浓度为0.1mol.L-1NaClO溶液和0.1mol?L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D