题目内容
【题目】如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是( )

A.粗盐水中含Ca2+、Mg2+、SO42-等离子,精制时除杂试剂BaCl2溶液应在Na2CO3溶液之前加入
B.标准状况下每生成22.4LCl2,便产生2 mol NaOH
C.从E口逸出的气体是Cl2
D.从B口加入含少量NaOH的水溶液以增强导电性
【答案】C
【解析】
A. 精制时除杂试剂BaCl2溶液过量,需使用Na2CO3溶液处理,所以应放在Na2CO3溶液之前加入,A正确;
B. 由反应2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑知,标准状况下每生成1molCl2,便产生2 mol NaOH,B正确;
2NaOH+Cl2↑+H2↑知,标准状况下每生成1molCl2,便产生2 mol NaOH,B正确;
C. 从Na+迁移的方向看,右边电极为阴极,水电离产生的H+得电子,所以从E口逸出的气体是H2,C错误;
D. 电解池右区获得纯净的NaOH溶液,为增强初始溶液的导电性,从B口加入含少量NaOH的水溶液,D正确。
故选C。

【题目】碳和碳的化合物广泛的存在于我们的生活中。
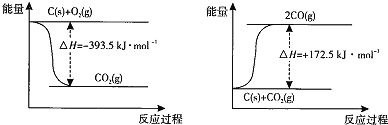
(1)根据下列反应的能量变化示意图,![]() ______ 。
______ 。
(2)在体积为2L的密闭容器中,充入1mol ![]() 和3mol H,一定条件下发生反应:
和3mol H,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的物质的量随时间变化的曲线如图所示:
的物质的量随时间变化的曲线如图所示:

①从反应开始到平衡,![]() 的平均反应速率
的平均反应速率![]() ______ 。
______ 。
②下列措施中能使化学平衡向正反应方向移动的是 ______ ![]() 填编号
填编号![]() 。
。
A.升高温度
![]() 将
将![]() 及时液化移出
及时液化移出
C.选择高效催化剂
![]() 再充入1mol
再充入1mol ![]() 和4mol
和4mol ![]()
(3)![]() 溶于水生成碳酸。已知下列数据:
溶于水生成碳酸。已知下列数据:
弱电解质 |
|
|
电离平衡常数 |
|
|
现有常温下![]() 的
的![]() 溶液,已知:
溶液,已知:![]() 水解的平衡常数
水解的平衡常数![]() ,
,![]() 第一步水解的平衡常数
第一步水解的平衡常数![]() 。
。
①判断该溶液呈 ______ ![]() 填“酸”、“中”、“碱”
填“酸”、“中”、“碱”![]() 性,写出该溶液中
性,写出该溶液中![]() 发生第一步水解的离子方程式 ______ 。
发生第一步水解的离子方程式 ______ 。
②下列粒子之间的关系式,其中正确的是 ______ 。
A.![]()
B.![]()
C.![]()
D.![]()
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以CO和![]() 为原料做成电池。原理如图所示:
为原料做成电池。原理如图所示:
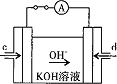
通入CO的管口是 ______ ![]() 填“c”或“d”
填“c”或“d”![]() ,写出该电极的电极反应式: ______ 。
,写出该电极的电极反应式: ______ 。








