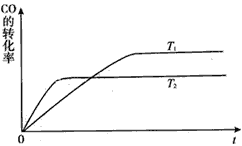
题目内容
【题目】短周期元素W、X、Y、Z分别属于三个周期,其原子序数依次增大,Y的原子半径是短周期主族元素中最大的。由W、X、Y、Z组成的物质之间存在下图所示的转化关系,其中m是元素Y的单质, n是元素Z的单质,通常为黄绿色气体,s的水溶液常用作漂白剂和消毒剂。
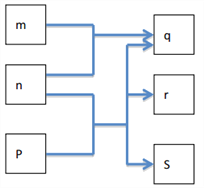
请回答下列问题:
(1)Y的元素符号是_____。常温时Z的最高价氧化物对应水化物的水溶液pH____7(填 大于、小于或等于)。
(2)X的元素符号是_____,它位于元素周期表中第____周期第____族,它与同主族相邻元素相比,非金性更强的是_______,能说明这一强弱关系的事实是______________。
(3)r的化学式是_______,p中存在的化学键类型是_________。用电子式表示q的形成过程________。
(4)n与p反应的化学方程式是___________,该反应中2mol n完全反应时转移电子的数目是_____NA
【答案】 Na 小于 O 二 VIA O H2O比H2S更稳定 H2O 离子键和共价键 ![]() Cl2 + 2NaOH=NaCl + NaClO + H2O 2
Cl2 + 2NaOH=NaCl + NaClO + H2O 2
【解析】本题分析:本题主要考查元素性质。
(1)因为Y的原子半径是短周期主族元素中最大的,所以Y是钠,Y的元素符号是Na。因为n是元素Z的单质,通常为黄绿色气体,所以Z是氯,常温时Z的最高价氧化物对应水化物是酸,其水溶液pH<7。
(2)因为短周期元素W、X、Y、Z分别属于三个周期,所以W是氢。q是氯化钠,氯化钠是氯气与氢氧化钠溶液反应的生成物,从氢氧化钠的组成可知X是氧,X的元素符号是O,它位于元素周期表中第二周期第VIA族,它与同主族相邻元素相比,非金性更强的是O,非金属性越强,其氢化物越稳定,能说明这一强弱关系的事实是H2O比H2S更稳定。
(3)s的水溶液常用作漂白剂和消毒剂,s是次氯酸钠,r是水,r的化学式是H2O ,p是氢氧化钠,p中存在的化学键类型是离子键和共价键,其中共价键存在于氢氧根内。。用电子式表示q的形成过程:![]() 。
。
(4)n与p反应的化学方程式是Cl2 + 2NaOH=NaCl + NaClO + H2O ,Cl2~e-,该反应中2mol n完全反应时转移电子的数目是2NA。

 名校课堂系列答案
名校课堂系列答案【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
请判断 X、Y、Z,并用相应的元素符号回答下列问题。
(1)X是_____,它的原子M层电子数是_______。
(2)表中元素原子半径最大的是________。
(3)Y在元素周期表中的位置是第____周期第_____族,用电子式表示Y的最简单氢化物的形成过程_____。
(4)氮气中氮原子之间的化学键属于_____键,由氮气与氢气反应生成1mol氨气时转移电子的数目是______NA。
(5)硫与Z两种元素相比,非金属性强的是______,请用化学方程式说明这一结论____________。
(6)碳、氮、Y三种元素的最简单气态氢化物的稳定性由强到弱的顺序是________。由最高价碳元素与最低价氮元素组成化合物的化学式是_________。