题目内容
17.(NH4)2SO4是常见的化肥和化工原料,受热易分解.某兴趣小组拟探究(NH4)2SO4受热分解产物.[查阅资料](NH4)2SO4在260℃和400℃时分解产物不同.
[实验探究]该小组拟选用图1所示装置进行实验(夹持和加热装置略)
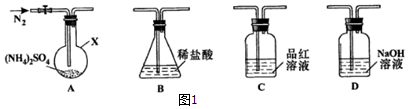
实验1:连接装置A-B-C-D,检査气密性,A中加入0.03mol (NH4)2SO4,装置B盛0.5000mol/L盐酸70.00mL.先通入N2排尽空气后,关闭活塞K,于260℃加热装置A 一段时间,停止加热,冷却,打开活塞K继续通N2一段时间,品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00Ml.经检验滴定后的溶液中无SO42-,装置A中(NH4)2SO4完全分解后有固体剩余.
(1)装置B的作用是吸收NH3(填化学式);已知260℃(NH4)2SO4加热完全分解的产物只有两种,结合题中数据,写出该温度下(NH4)2SO4 分解的化学方程式(NH4)2SO4 $\frac{\underline{\;260°C\;}}{\;}$NH4HSO4+NH3↑.
(2)滴定前,下列关于碱式滴定管的操作的正确顺序是dbaec(填字母编号).
a.盛装0.2000mol/LNaOH溶液 b.用0.2000mol/LNaOH溶液润洗
c.读数、记录 d.查漏、清洗 e.排尽滴定管尖嘴的气泡并调整液面
(3)加热后继续通入N2的目的是使分解产生的气体全部逸出被充分吸收.
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂.通入N2排尽空气后,与400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2.观察到装置A、D之间的导气管内有少量白色固体.经检验,该白色固体和装置D内溶液中有SO32-,无SO42-.进一步研究发现,气体产物中无氮氧化物.
(4)由题述信息判断400℃时(NH4)2SO4加热分解的产物中一定没有氧气的理由是装置D内溶液中有SO32-,无SO42-.
(5)400℃时(NH4)2SO4完全分解后无固体残留,且氧化产物和还原产物各只有一种,则氧化产物是N2,还原产物是SO2.
(6)用下列装置测定一种分解产物的量.
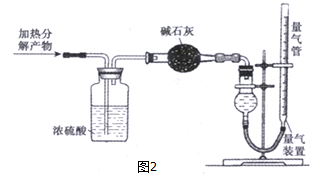
量气装置中收集到的气体是N2,收集完气体并恢复至室温,读数前应进行的操作是将量气管两边的液面调平.
分析 (1)根据消耗氢氧化钠计算B装置中剩余的HCl,参加反应的HCl吸收分解生成的NH3,发生反应:NH3+HCl=NH4Cl,进而计算吸收NH3的物质的量,
(2)滴定前,先检查滴定管是否漏水,再进行清洗,然后用标准液润洗,再注入标准液,排尽滴定尖嘴的气泡并调整液面,读数、记录,滴定前准备完成;
(3)加热后继续通入N2的主要作用是赶净装置内生成的气体全部吸收;
(4)SO32-易被氧气氧化生成硫酸根离子分析;
(5)装置D内溶液中有SO32-,说明分解生成SO2,装置A、D之间的导气管内有少量白色固体,白色固体应是二氧化硫、氨气与水形成的盐,装置B内溶液吸收的气体是氨气,分析可知,(NH4)2SO4在400℃分解时,有NH3、SO2、H2O生成,S元素化合价降低,根据电子转移守恒,只能为N元素化合价升高,气体产物中无氮氧化物,说明生成N2,配平书写方程式得到氧化产物和还原产物;
(6)加热分解产物通过浓硫酸吸收氨气、水,过碱石灰吸收生成的二氧化硫,最后收集气体为氮气,读数时,应使左右压强相等.
解答 解:(1)滴定剩余盐酸,终点时消耗NaOH为0.025L×0.2mol/L=0.005mol,故剩余HCl为0.005mol,则参加反应的HCl为0.07L×0.5mol/L-0.005mol=0.03mol,参加反应的HCl吸收分解生成的NH3,发生反应:NH3+HCl=NH4Cl,故吸收NH3的物质的量为0.03mol,已知260℃(NH4)2SO4加热完全分解的产物只有两种计算可知还有市场的氨气,
故答案为:NH3; (NH4)2SO4$\frac{\underline{\;260°C\;}}{\;}$NH4HSO4+NH3↑;
(2)滴定前,先检查滴定管是否漏水,再进行清洗,然后用标准液润洗,再注入标准液,排尽滴定尖嘴的气泡并调整液面,读数、记录,滴定前准备完成,故正确的顺序为:dbaec,
故答案为:dbaec;
(3)加热后继续通入N2的目的是使分解产生的气体全部逸出被充分吸收,
故答案为:使分解产生的气体全部逸出被充分吸收;
(4)检查气密性,按图示重新加入试剂.通入N2排尽空气后,与400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2.观察到装置A、D之间的导气管内有少量白色固体.经检验,该白色固体和装置D内溶液中有SO32-,无SO42-.说明一定无氧气生成,
故答案为:装置D内溶液中有SO32-,无SO42-;
(5)装置D内溶液中有SO32-,说明分解生成SO2,装置A、D之间的导气管内有少量白色固体,白色固体应是二氧化硫、氨气与水形成的盐,装置B内溶液吸收的气体是氨气,分析可知,(NH4)2SO4在400℃分解时,有NH3、SO2、H2O生成,S元素化合价降低,根据电子转移守恒,只能为N元素化合价升高,气体产物中无氮氧化物,说明生成N2,分解反应方程式为:3(NH4)2SO4$\frac{\underline{\;400°C\;}}{\;}$4NH3↑+3SO2↑+6H2O↑+N2↑,氧化产物是N2,还原产物是SO2,
故答案为:N2; SO2;
(6)加热分解产物通过浓硫酸吸收氨气、水,过碱石灰吸收生成的二氧化硫,最后收集气体为氮气,读数时,应使左右压强相等保证读数准确,可上下移动滴定管,使左右两边液面相平,
故答案为:故答案为:N2; 将量气管两边的液面调平.
点评 本题考查化学实验,涉及化学仪器、滴定操作、实验方案设计、化学计算、物质推断、化学方程式书写等,是对学生综合能力的考查,较好的考查学生分析推理能力、知识迁移运用能力难度中等.

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案| A. | 容器内压强P:P甲=P丙>2P乙 | |
| B. | SO2的质量m:m甲=m丙>2m乙 | |
| C. | c(SO2)与c(O2)之比k:k甲=k丙=2k乙 | |
| D. | 甲乙中SO2的转化率分别为ɑ甲、ɑ乙,丙中SO3的转化率为ɑ丙:ɑ甲>ɑ乙,ɑ甲+ɑ丙=1 |
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
| A. | 若可以水解,且能发生银镜反应,则其同分异构有8种 | |
| B. | 若可以与碳酸氢钠溶液反应生成CO2,则其同分异构有8种 | |
| C. | 一定能与Na反应生成H2 | |
| D. | 可能与NaOH溶液反应 |
为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是
选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
A | NH3(H2O) | 浓硫酸 | 洗气 |
B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
C | KCl固体(I2) | KOH溶液 | 加热 |
D | 苯(苯酚) | 浓溴水 | 过滤 |



 +R3
+R3 $\stackrel{C_{2}H_{5}ONa}{→}$
$\stackrel{C_{2}H_{5}ONa}{→}$ +R2OH
+R2OH .
. .
. .
. 的CaSO4,可先用Na2CO3溶液处理,后用酸除去
的CaSO4,可先用Na2CO3溶液处理,后用酸除去