题目内容
【题目】2SO2(g)+O2(g)===2SO3(g)反应过程的能量变化如图所示。
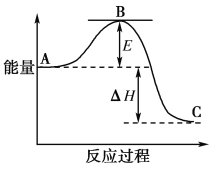
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:
(1)图中A、C分别表示______________、________________,E的大小对该反应的反应热________(填“有”或“无”)影响;
(2)该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是________________________________________________________________________________;
(3)图中ΔH=________kJ·mol-1;
(4)已知单质硫的燃烧热ΔH=-296 kJ·mol-1,计算由S(s)生成1 mol SO3(g)的ΔH________(写出计算过程)。
【答案】反应物总能量 生成物总能量 无 降低 催化剂(V2O5)改变了反应的历程,使活化能E降低 -198 S(s)+O2(g)===SO2(g) ΔH1=-296 kJ·mol-1,
SO2(g)+1/2O2(g)===SO3(g) ΔH2=-99 kJ·mol-1,
S(s)+3/2O2(g)===SO3(g) ΔH=ΔH1+ΔH2=-395 kJ·mol-1
【解析】
(1)A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关;
(2)加入催化剂,活化能减小,反应反应热不变;
(3)由1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ·mol-1可知2SO2(g)+O2(g)=2SO3(g) ΔH=-198kJ·mol-1;
(4)单质硫的燃烧热为296KJmol-1,所以热化学方程式为:S(s)+O2(g)═SO2(g)△H=-296kJ/mol,利用盖斯定理解答该题。
(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热是A、C所具有的总能量之差,活化能的大小与反应热无关,
故答案为:反应物总能量;生成物总能量;无。
(2)催化剂降低反应的活化能加快反应的速率,但不能改变反应热,催化剂(V2O5)改变了反应的历程,使活化能E降低;故答案为:降低,催化剂(V2O5)改变了反应的历程,使活化能E降低。
(3)因为1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ·mol-1,所以2molSO2(g)氧化为2molSO3(g)的ΔH=-198kJ·mol-1,则2SO2(g)+O2(g)=2SO3(g) ΔH=-198kJ·mol-1,故答案为:-198。
(4)因单质硫的燃烧热为296kJmol-1,则S(s)+O2(g)=SO2(g)△H=-296kJmol-1,
而1molSO2(g)氧化为1molSO3的△H=-99kJmol-1,则SO2(g)+1/2O2(g)=SO3(g)△H=-99kJmol-1,由盖斯定律可得:S(s)+3/2O2(g)=SO3(g)△H=-296kJmol-1+(-99kJmol-1)=-395kJmol-1,
故答案为:S(s)+O2(g)=SO2(g) ΔH1=-296kJ·mol-1,SO2(g)+1/2O2(g)=SO3(g) ΔH2=-99kJ·mol-1,S(s)+3/2O2(g)=SO3(g) ΔH=ΔH1+ΔH2=-395 kJ·mol-1。





