题目内容
14.某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O.已知K2S2O8的氧化性比K2Cr2O7强.请将以上反应物与生成物编写成一个氧化还原反应方程式并配平7H2O+Cr2(SO4)3+3K2S2O8=7H2SO4+2K2SO4+K2Cr2O7.分析 依据反应体系中的物质Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O,K2S2O8的氧化性比K2Cr2O7强,所以K2S2O8是氧化剂,K2SO4、H2SO4是还原产物,Cr2(SO4)3是还原剂,K2Cr2O7是氧化产物,分析反应物中元素化合价变化,依据得失电子守恒规律、原子个数守恒规律配平方程式.
解答 解:依据反应体系中的物质Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O,K2S2O8的氧化性比K2Cr2O7强,所以K2S2O8是氧化剂,K2SO4、H2SO4是还原产物,Cr2(SO4)3是还原剂,K2Cr2O7是氧化产物,K2S2O8→K2SO4、H2SO4硫元素化合价降低1,Cr2(SO4)3→K2Cr2O7铬元素化合价升高3,依据得失电子守恒规律
K2S2O8系数为3,Cr2(SO4)3系数为1,依据原子个数守恒,反应方程式:
7H2O+Cr2(SO4)3+3K2S2O8=7H2SO4+2K2SO4+K2Cr2O7,
故答案为:7H2O+Cr2(SO4)3+3K2S2O8=7H2SO4+2K2SO4+K2Cr2O7.
点评 本题考查了氧化还原方程式的书写,明确物质氧化性、还原性强弱规律,依据得失电子守恒、原子个数守恒即可解答,题目难度中等.

练习册系列答案
相关题目
6.在常温下,将一定体积的某 NaOH 溶液分成两等分,与pH均为2的一元酸 HA、HB恰好中和,消耗两种酸溶液的体积分别为V1、V2(V1≠V2).则下列叙述中正确的是( )
| A. | 若 Vl>V2,则说明HA的酸性比 HB的酸性强 | |
| B. | 中和后得到的两种溶液的pH均为 7 | |
| C. | 分别将两种酸溶液稀释10 倍后溶液的pH均为3 | |
| D. | 分别往等体积的两种酸溶液中加人足量锌粉,充分反应后产生的H2的体积相等 |
4.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 88g乙酸乙酯中存在的共价键总数为14NA | |
| C. | 加热时,含2molH2SO4的浓硫酸与足量铜反应,转移的电子数为2NA | |
| D. | 1mol羟基所含的电子数为10NA |
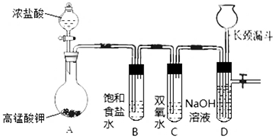 Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证该结论,学生设计了如图所示的实验装置进行实验(夹持装置略去).请回答下列问题:
Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证该结论,学生设计了如图所示的实验装置进行实验(夹持装置略去).请回答下列问题: HCl+HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.(用方程式回答).对于质疑可以采用对比实验解决.
HCl+HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.(用方程式回答).对于质疑可以采用对比实验解决.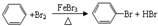 ,预测该芳香烃能(填“能”或“不能”)发生该类反应.
,预测该芳香烃能(填“能”或“不能”)发生该类反应.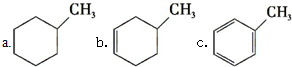
 c.
c.