题目内容
【题目】设NA为阿伏加德罗常数的值。下列叙述不正确的是
A. 标准状况下,0.56L 丙烷中含有共价键的数目为0.25NA
B. 常温常压下,6.4g氧气和臭氧的混合物中含有的原子总数为0.4NA
C. 5.6g铁与一定量硝酸恰好反应,转移的电子数目一定为0.3NA
D. 一定条件下,28gN2与6gH2反应,转移的电子数小于6NA
【答案】C
【解析】A. 标准状况下,0.56L 丙烷的物质的量为![]() =0.025mol,含有共价键的物质的量为
=0.025mol,含有共价键的物质的量为![]() ×(3×4+8×1)×0.025mol=0.25mol,故A正确;B. 常温常压下,6.4g氧气和臭氧的混合物中含有氧原子的物质的量为
×(3×4+8×1)×0.025mol=0.25mol,故A正确;B. 常温常压下,6.4g氧气和臭氧的混合物中含有氧原子的物质的量为![]() =0.4mol,故B正确;C. 铁与一定量硝酸恰好反应可能生成硝酸铁,也可能生成硝酸亚铁,转移的电子数目不一定为0.3NA,故C错误;D. 氮气与氢气的反应属于可逆反应,28gN2与6gH2不可能完全反应反应,转移的电子数小于6NA,故D正确;故选C。
=0.4mol,故B正确;C. 铁与一定量硝酸恰好反应可能生成硝酸铁,也可能生成硝酸亚铁,转移的电子数目不一定为0.3NA,故C错误;D. 氮气与氢气的反应属于可逆反应,28gN2与6gH2不可能完全反应反应,转移的电子数小于6NA,故D正确;故选C。
点晴:本题考查阿伏加德罗常数的有关计算。注意明确阿伏伽德罗常数的概念,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系。本题的易错点是D,注意反应的可逆性。

【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。
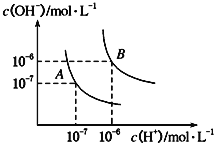
①100℃时1mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量 NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+) c(CH3COO-) (填“>”、“<”或“=”);

