题目内容
11.在铜锌原电池中,锌电极上发生的反应为Zn-2e-=Zn2+,则不正确的是( )| A. | 锌电极为负极 | B. | 铜电极为正极 | C. | 反应中Zn被氧化 | D. | 反应中铜被还原 |
分析 在原电池中,失电子的金属作负极,失电子的物质发生氧化反应而作还原剂,得电子的物质发生还原反应而作氧化剂,氧化剂被还原,还原剂被氧化.
解答 解:A、锌失电子发生氧化反应而作负极,故A正确;
B、铜不如锌活泼,铜作正极,故B正确;
C、在该反应中锌作还原剂,还原剂被氧化,故C正确;
D、铜作正极,Cu电极不参与反应,故D错误;
故选D.
点评 本题考查了原电池原理,根据得失电子及反应类型来确定正负极,注意不能根据金属的活泼性强弱确定正负极,要根据得失电子难易程度确定正负极,题目难度不大.

练习册系列答案
相关题目
1.下列物质一定属于同系物的是( )
①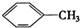 ②
②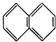 ③
③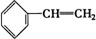 ④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦
④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦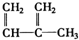 ⑧
⑧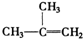
①
 ②
② ③
③ ④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦
④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦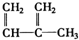 ⑧
⑧
| A. | ①和 ② | B. | ④和⑥ | C. | ⑤和⑦ | D. | ④和⑧ |
2.提纯下列物质所选试剂及对应分离方法均可行的是( )
| 物质 | 杂质 | 所选试剂 | 方法 | |
| A | 乙烷 | 乙烯 | 酸性KMnO4溶液 | 洗气 |
| B | 溴苯 | 溴 | H2O | 萃取 |
| C | 乙炔 | 硫化氢 | 硫酸铜溶液 | 洗气 |
| D | 乙酸乙酯 | 乙酸 | 饱和Na2CO3溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
19.均不属于大气污染物的一组气体是( )
| A. | N2和O2 | B. | CO和CO2 | C. | NO和NO2 | D. | SO2和碳氢化合物 |
6.下列说法正确的是( )
| A. | 钠的金属性比钾强 | |
| B. | 溴的非金属性比氯强 | |
| C. | IIA族中原子半径最小的是铍 | |
| D. | 第二周期中,除稀有气体元素外原子半径最大的是锂 |
16.Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授荣获1998年诺贝尔医学及生理学奖.关于NO的下列叙述中不正确的是( )
| A. | NO可以是某些含低价N物质氧化的产物 | |
| B. | NO难溶于水 | |
| C. | NO可以是某些含高价N物质还原的产物 | |
| D. | NO是红棕色气体 |
20.金刚石与石墨是碳元素的两种结构不同的单质,彼此互称同素异形体.在100kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热能.据此判断在100kPa压强下,下列说法正确的是( )
| A. | 金刚石比石墨更稳定 | |
| B. | 石墨比金刚石更稳定 | |
| C. | 1 mol金刚石比1 mol石墨的总能量低 | |
| D. | 1 mol金刚石转变为石墨需要吸收1.895 kJ能量 |
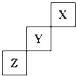 短周期元素X、Y、Z在周期表中位置关系如图所示,
短周期元素X、Y、Z在周期表中位置关系如图所示, .写出Z单质与铁反应的化学反应方程式:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS.
.写出Z单质与铁反应的化学反应方程式:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS. ,
, .
.