题目内容
实验室可用下列方法制取气体,其中必须用排水法收集的是
- A.锌与稀硫酸反应
- B.碳酸钙与稀盐酸反应
- C.铜片与稀硝酸反应
- D.二氧化锰与双氧水混合
分析:能够在空气中稳定存在并且密度明显大于空气的气体或小于空气的气体可以用排空气集气法收集,与水不发生化学反应,并且溶解度不大的气体可以用排水发收集.
解答:A、氢气在空气中能稳定存在且密度明显小于空气的密度,所以可用排空气集气法收集;氢气不易溶于水,和水不发生化学反应,所以可用排水法收集,故A错误.
B、二氧化碳在空气中能稳定存在且密度明显大于空气的密度,所以可用排空气集气法收集;二氧化碳能和水反应生成碳酸,溶解度较大,所以不能用排水法收集,故B错误.
C、一氧化氮能和空气中的氧气发生生成二氧化氮,即一氧化氮不能在空气中稳定存在,所以不能用排空气集气法收集;一氧化氮不易溶于水,和水不反应,所以能用排水集气法收集,故C正确.
D、氧气能够在空气中稳定存在且密度明显大于空气的密度,所以能用排空气集气法收集;氧气在水中的溶解度较小,和水不反应,所以能用排水集气法收集,故D错误.
故选C.
点评:本题考查了气体的收集方法的选取,难度不大,根据气体的性质和溶解性确定收集方法即可.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| |||||||||||||||
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
① CS2+3Cl2 CCl4+S2Cl2;② 2S+Cl2
CCl4+S2Cl2;② 2S+Cl2 S2Cl2。
S2Cl2。
已知S2Cl2中硫元素显+1价,电子式: ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
|
物质 |
S |
CS2 |
CCl4 |
S2Cl2 |
|
沸点/℃ |
445 |
47 |
77 |
137 |
|
熔点/℃ |
113 |
-109 |
-23 |
-77 |
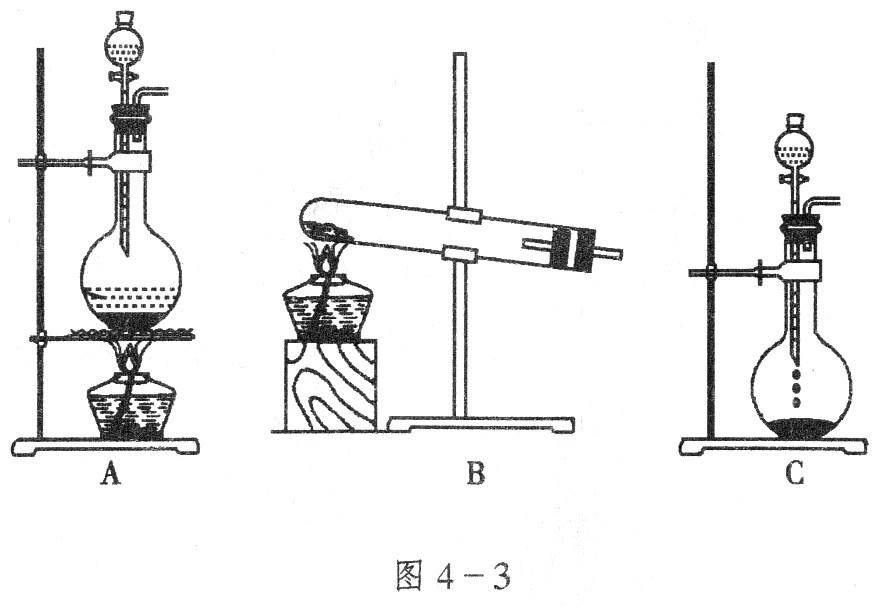
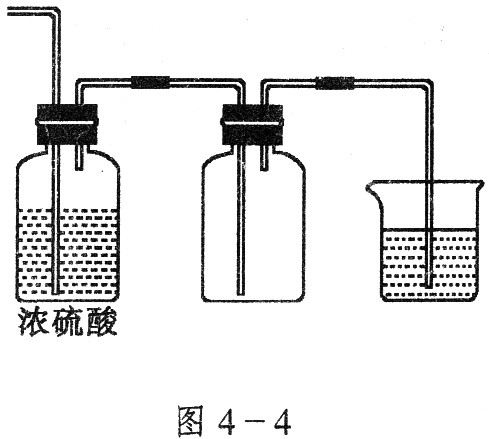
实验室利用下列装置制备S2Cl2(部分夹持仪器已略去):

回答下列问题:
(1)装置B、C中玻璃容器的名称: ;反应原理(填写数字序号): 。
(2)实验中盐酸试剂通常采用36.5%的浓溶液,不用稀盐酸的理由是 。
(3)D中冷凝管起到导气和冷凝双重作用,其冷却水流动方向与热气流流动方向相同(见图)。这种冷却方式可应用于下列高中化学中 实验。
A.石油分馏 B.制取溴苯 C.制取乙酸乙酯 D.制备阿司匹林
(4)B装置中盛放的是 ,反应结束后从锥形瓶内混合物中分离出产品的方法是 ,D中采用热水浴加热的原因是 。
(5)A部分仪器装配时,放好铁架台后,应先固定 (填仪器名称),整套装置装配完毕后,应先进行 再添加试剂。实验完毕,A中不再产生氯气时,可拆除装置。拆除时,最先的操作应当是 。
(6)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因可用化学方程式表示为 。实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是: (用离子方程式表示)。