题目内容
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
① CS2+3Cl2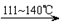 CCl4+S2Cl2;② 2S+Cl2
CCl4+S2Cl2;② 2S+Cl2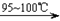 S2Cl2。
S2Cl2。
已知S2Cl2中硫元素显+1价,电子式: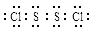 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低)。反应涉及的几种物质的熔沸点如下:
|
物质 |
S |
CS2 |
CCl4 |
S2Cl2 |
|
沸点/℃ |
445 |
47 |
77 |
137 |
|
熔点/℃ |
113 |
-109 |
-23 |
-77 |
实验室利用下列装置制备S2Cl2(部分夹持仪器已略去):
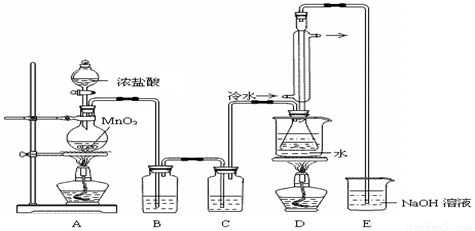
回答下列问题:
(1)装置B、C中玻璃容器的名称: ;反应原理(填写数字序号): 。
(2)实验中盐酸试剂通常采用36.5%的浓溶液,不用稀盐酸的理由是 。
(3)D中冷凝管起到导气和冷凝双重作用,其冷却水流动方向与热气流流动方向相同(见图)。这种冷却方式可应用于下列高中化学中 实验。
A.石油分馏 B.制取溴苯 C.制取乙酸乙酯 D.制备阿司匹林
(4)B装置中盛放的是 ,反应结束后从锥形瓶内混合物中分离出产品的方法是 ,D中采用热水浴加热的原因是 。
(5)A部分仪器装配时,放好铁架台后,应先固定 (填仪器名称),整套装置装配完毕后,应先进行 再添加试剂。实验完毕,A中不再产生氯气时,可拆除装置。拆除时,最先的操作应当是 。
(6)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因可用化学方程式表示为 。实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是: (用离子方程式表示)。
(14分)
(1)广口瓶 ① (每格1分)
(2)稀盐酸还原性弱,反应困难 (2分,只说出反应困难或不反应,没说到还原性弱
给1分)
(3)BD(2分)
(4)饱和食盐水 蒸馏 使CS2平稳汽化,避免产物S2Cl2汽化(每格1分) l (每格1分)
(5)酒精灯 气密性检查 将E中长导管移开液面 (每格1分)
(6)2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑ ClO-+2H++Cl-=Cl2↑+H2O (每格1分)
【解析】
试题分析:
(1)从实验装置图中可以看出,A为为制取Cl2,B、C为净化,故B除HCl,C吸收水蒸气,D中S与氯气发生反应生成S2Cl2;
(2)制取氯气需要使用浓盐酸,稀盐酸不反应;
(3)在这里起到的作用是冷凝回流,故选BD;
(4)B中作用是吸收HCl,可以使用饱和食盐水,从锥形瓶中有S、S2Cl2等,可以使用蒸馏的方法分离。
(5)仪器装配的原则是从下到上,从左到右。
(6)若缺少干燥装置,生成的S2Cl2有一部分发生水解生成S和SO2,故能看到浑浊。E为Cl2与NaOH反应生成NaCl和NaClO,加入浓盐酸后又反应生成Cl2。
考点:考查化学实验基本原理(气体制备),实验仪器,基本操作,元素及化合物知识等。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案