题目内容
有A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大(按A、B、C的顺序),将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子(不考虑难溶物自身的溶解),同时生成一种阴、阳离子个数比为1:1的白色沉淀。请回答下列问题:
(1)经检验,三种正盐中还含有下列选项中的一种离子,该离子是________.
A.Na+ B.Mg2+ C.Cu2+ D.Ag+
(2)三种正盐的化学式分别是:A ,B ,C
(3) A、B、C同时溶于水时反应的离子方程式为
(1)经检验,三种正盐中还含有下列选项中的一种离子,该离子是________.
A.Na+ B.Mg2+ C.Cu2+ D.Ag+
(2)三种正盐的化学式分别是:A ,B ,C
(3) A、B、C同时溶于水时反应的离子方程式为
(1) D(1分)
(2) FeCl3,AgNO3,K2SO4(各2分)
(3) Ag++Cl-=AgCl↓(2分)
(2) FeCl3,AgNO3,K2SO4(各2分)
(3) Ag++Cl-=AgCl↓(2分)
试题分析:生成一种阴、阳离子个数比为1:1的白色沉淀,从给出的5种离子少了一种阳离子说明完全沉淀,白色沉淀不可能是硫酸盐(因为等物质的量正盐,如果是硫酸盐那么硫酸根离子就没有剩余)只能是氯化银,又根据阴、阳离子各不相同,其阴离子的摩尔质量依次增大(按A、B、C的顺序)B只能是硝酸银,氯离子有剩余所以A应是氯化铁,C既是硫酸钾。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
 ,H2SO3,NH
,H2SO3,NH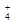 )分别进行如下实验:
)分别进行如下实验: 、
、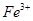 、
、 、
、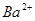 、
、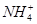 等阳离子。某同学进行如下实验:
等阳离子。某同学进行如下实验: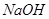 溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。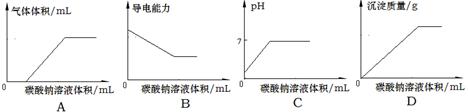
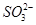 之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想:
之间发生怎样的反应,请你一起参与并协助他们完成实验。(1)提出猜想: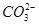 小外,还有_ _______。
小外,还有_ _______。