题目内容
在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少
(1)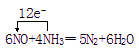
(2)有两种情况:
① NH3过量时:n(NO)=0.3mol n(NH3)=0.7mol
② NO过量时:n(NO)=0.8mol n(NH3)=0.2mol
解析:
本题主要目的是考查学生根据化学方程式计算的能力,同时考查学生对氧化还原反应中电子转移的方向和数目的理解。
本题的起点极低,已知反应物是NO和NH3,生成物是N2和H2O,要求学生写出反应的化学方程式。氧化还原反应的电子转移的方向和数目这一知识点,是高中化学的重点。第⑴问不难回答。解答第⑵问的核心是“差量法”。由化学方程式6NO+4NH3=5N2+6H2O可得6mol NO 还原得到3mol N2,4mol NH3氧化得到2mol N2,两者相差1molN2。现相差1.4g,1.4g÷28gmol-1=0.05mol,相当于0.3molNO和0.2molNH3反应。依题意NO和NH3的总物质的量为1mol,其中必有一种为过量。若NO过量,则NO的物质的量为0.5mol与0.3mol之和即0.8mol,而NH3的物质的量为0.2mol;如果NH3过量,则结论是NO0.3mol,NH3是(0.2mol+0.7mol)即0.7mol。

练习册系列答案
相关题目