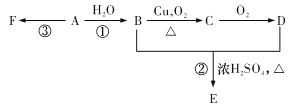
题目内容
【题目】298K时,向体积均为15.0mL、浓度均为1.00moL/L的氨水和NaHCO3溶液中分别滴加1.00mol/L的盐酸,溶液的pH与所加盐酸体积的关系如图所示。下列有关叙述正确的是

A. 两个滴定过程均可选择酚酞作指示剂
B. 曲线a是NaHCO3溶液的滴定曲线
C. 当V(盐酸)=4.00mL时,c(HCO3-)>c(NH4+)>c(CO32-)
D. 当V(盐酸)= 15.00mL时,c(Na+)=c(NH4+)
【答案】C
【解析】A、指示剂的选择:指示剂的变色范围应与滴定终点后溶液的酸碱性一致,NH3·H2O是弱碱,滴定到终点后,溶液中的溶质为NH4Cl,溶液显酸性,因此用甲基橙作指示剂,NaHCO3溶液不能使酚酞变红,NaHCO3溶液中滴加盐酸,应用甲基橙作指示剂,故A错误;B、NH3·H2O是弱碱,NaHCO3是盐溶液,相同浓度时,NH3·H2O的pH大于NaHCO3,因此a曲线为NH3·H2O的滴定曲线,故B错误;C、发生NH3·H2O+HCl=NH4Cl+H2O,起始时,加入15mL1.00mol·L-1NH3·H2O,现在加入盐酸的体积为4mL,盐酸不足,NH3·H2O过量,反应后溶质为NH3·H2O和NH4Cl,且NH3·H2O的物质的量大于NH4Cl,同理,NaHCO3溶液中滴加4mL的盐酸,溶质为NaHCO3和NaCl,且NaHCO3物质的量大于NaCl,如果不考虑NH4+的水解,n(NaCl)=n(NH4Cl),因此有c(HCO3-)>c(NH4+),HCO3-以水解为主,HCO3-能够电离出极少量的CO32-,离子浓度大小顺序是c(HCO3-)>c(NH4+)>c(CO32-),故C正确;D、当加入15mL的盐酸,NH3·H2O与盐酸恰好完全反应,溶质为NH4Cl,同理NaHCO3与盐酸恰好完全反应,溶质为NaCl,如果不考虑NH4+的水解,n(NH4Cl)=n(NaCl),但NH4+发生水解,因此有c(Na+)>c(NH4+),故D错误。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是__________(填“增大”、“减小”或“不变”,下同),ΔH的变化是__________。请写出NO2和CO反应的热化学方程式___________________。

(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
且H2O(g)==H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为_______________。
(3)如表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | a | b | c | x |

已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=__________ kJ·mol-1(用含a、b、c、d的代表数式表示)。