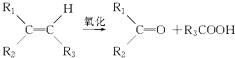
题目内容
【题目】利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示: 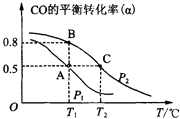
(1)写出该反应的平衡常数表达式为 .
(2)上述合成甲醇的反应为反应(填“放热”或“吸热”). A、B、C三点的平衡常数KA、KB、KC的大小关系为 . A、B两点对应的压强大小关系是PAPB(填“大于”、“小于”或“等于”).
(3)若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为H2SO4溶液,则该电池工作时负极的电极反应式为 , 理论上通过外电路的电子最多为mol.
【答案】
(1)![]()
(2)放热;KA=KB>KC;小于
(3)CH3OH(g)+H2O﹣6e﹣=CO2+6H+1;30
【解析】解:(1)反应的化学方程式为CO(g)+2H2(g)CH3OH(g),平衡常数K= ![]() ,所以答案是:
,所以答案是: ![]() ;(2)从图上可见,在P2时,随温度的升高CO的转化率越来越低,可见,升温时平衡向逆向移动,据勒夏特列原理,正反应放热.化学平衡常数只受温度的影响,该反应放热,温度越高平衡逆向移动,K值减小.相同温度下,增大压强平衡右移,CO的转化率增大,即CO转化率越大压强越大,所以答案是:放热; KA=KB>KC;小于;(3)甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,负极电极反应为:CH3OH(g)+H2O﹣6e﹣=CO2+6H+ . 由图示可知,在平衡状态A时,CO转化率为0.5,可知生成甲醇的物质的量为5mol,根据电极反应式可知失去电子数为:5mol×6=30mol,所以答案是:CH3OH(g)+H2O﹣6e﹣=CO2+6H+;30.
;(2)从图上可见,在P2时,随温度的升高CO的转化率越来越低,可见,升温时平衡向逆向移动,据勒夏特列原理,正反应放热.化学平衡常数只受温度的影响,该反应放热,温度越高平衡逆向移动,K值减小.相同温度下,增大压强平衡右移,CO的转化率增大,即CO转化率越大压强越大,所以答案是:放热; KA=KB>KC;小于;(3)甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,负极电极反应为:CH3OH(g)+H2O﹣6e﹣=CO2+6H+ . 由图示可知,在平衡状态A时,CO转化率为0.5,可知生成甲醇的物质的量为5mol,根据电极反应式可知失去电子数为:5mol×6=30mol,所以答案是:CH3OH(g)+H2O﹣6e﹣=CO2+6H+;30.
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征和化学平衡的计算的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 阅读快车系列答案
阅读快车系列答案