题目内容
4.元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N分别代表某种化学元素.请依据这8种元素回答下列问题.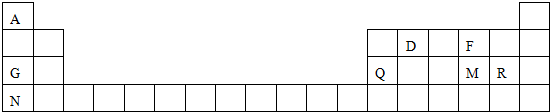
(1)表中F的原子结构示意图为
 .
.(2)金属性最强的元素是在元素周期表中的位置第四周期第IA族.
(3)M、R两种元素所形成的气态氢化物中较不稳定的是H2S(用化学式表示).
(4)R的最高价氧化物对应水化物的化学式是HClO4.
(5)G、Q两元素的最髙价氧化物对应水化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是S2->Cl->K+(填离子符号).
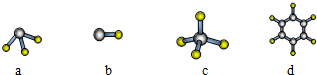
(7)A与D形成分子的空间结构可能是(填序号)cd.
分析 根据元素在周期表中的位置知,A、D、F、G、Q、M、R、N分别是H、C、O、Na、Al、S、Cl、K元素,
(1)F是O元素,其原子核外有2个电子层、最外层电子数是6;
(2)金属性最强的元素是在元素周期表的左下角,这几种元素中金属性最强的是K元素;
(3)元素的非金属性越强,其氢化物的稳定性越强;
(4)R是Cl元素,Cl的最高价氧化物对应水化物是高氯酸;
(5)G、Q两元素的最髙价氧化物对应水化物分别是NaOH、Al(OH)3,二者反应生成偏铝酸钠和水;
(6)电子层结构相同的离子,离子半径随着原子序数增大而减小;
(7)A与D形成分子有甲烷、乙烯、乙炔、苯等,甲烷是正四面体结构、乙烯是平面结构、乙炔是直线形结构、苯是平面结构.
解答 解:根据元素在周期表中的位置知,A、D、F、G、Q、M、R、N分别是H、C、O、Na、Al、S、Cl、K元素,
(1)F是O元素,其原子核外有2个电子层、最外层电子数是6,其原子结构示意图为,故答案为: ,
,
故答案为: ;
;
(2)金属性最强的元素是在元素周期表的左下角,这几种元素中金属性最强的是K元素,位于第四周期第IA族,故答案为:第四周期第IA族;
(3)元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S,所以氢化物较不稳定的是H2S,故答案为:H2S;
(4)R是Cl元素,Cl的最高价氧化物对应水化物是高氯酸,其化学式为HClO4,故答案为:HClO4;
(5)G、Q两元素的最髙价氧化物对应水化物分别是NaOH、Al(OH)3,二者反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(6)电子层结构相同的离子,离子半径随着原子序数增大而减小,离子半径大小顺序是S2->Cl->K+,故答案为:S2->Cl->K+;
(7)A与D形成分子有甲烷、乙烯、乙炔、苯等,甲烷是正四面体结构、乙烯是平面结构、乙炔是直线形结构、苯是平面结构,只有cd正确,故选cd.
点评 本题考查元素周期表和元素周期律的综合应用,涉及离子方程式的书写、物质结构判断、元素周期律等知识点,正确判断元素及物质结构和性质是解本题关键,知道非金属性强弱判断方法,题目难度不大.

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案| A. | 非电解质:乙醇,氯气,乙酸 | |
| B. | 醇:甘油,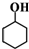 , ,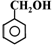 | |
| C. | 分子晶体:干冰,碘单质,蔗糖 | |
| D. | 混合物:铝热剂,聚乙烯,分析纯盐酸 |
| A. | 煤的干馏、石油的分馏都只发生了物理变化 | |
| B. | 棉、麻、丝、毛完全燃烧都只生成了CO2和H2O | |
| C. | 甲烷和苯都能发生取代反应 | |
| D. | 乙醇和乙酸互为同分异构体 |
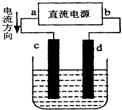
| A. | a为负极,c为阴极发生氧化反应 | |
| B. | 电子从电源的负极沿导线流入电解池的阴极 | |
| C. | 电解过程中,d电极:2Cl--2e-═Cl2↑ | |
| D. | 若反应过程中,有2.24 L 气体产生,则有0.2 mol电子发生转移 |
| A. | 20 mol•L-1•s-1 | B. | 40 mol•L-1•s-1 | C. | 60 mol•L-1•s-1 | D. | 150mol•L-1•s-1 |
| A. |  根据图可判断正反应的△H<0 | |
| B. |  根据图,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5 | |
| C. | 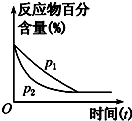 图可表示压强(p)对反应2A(g)+2B(g)?3C(g)+D(s)的影响 | |
| D. |  图为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |