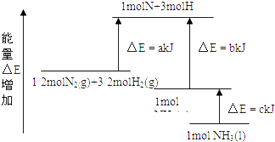
题目内容
【题目】可逆反应mA(固)+nB(气)Pc (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( ) 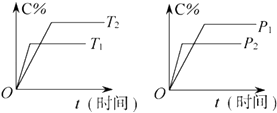
A.达到平衡后,使用催化剂,C%将增大
B.达到平衡后,若升高温度,化学平衡向逆反应方向移动
C.方程式中n>p+q
D.达到平衡后,增加A的量有利于化学平衡向正反应方向移动
【答案】B
【解析】解:可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象(1)可知T1>T2 , 温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图(2)可知p2>p1 , 压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即n<P+q.
A、催化剂只改变化学反应速率,对平衡移动没有影响,C的质量分数不变,故A错误;
B、由上述分析可知,可逆反应mA(固)+nB(气)Pc (气)+qD(气)正反应为放热反应,升高温度平衡向吸热方向移动,即向逆反应移动,故B正确;
C、由上述分析可知,可逆反应mA(固)+nB(气)Pc (气)+qD(气)正反应为气体物质的量增大的反应,即n<P+q,故C错误;
D、A为固体,浓度为定值,达平衡后,增加A的量,平衡不移动,故D错误.
故选B.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目