题目内容
【题目】用图中的实验装置制取乙炔. 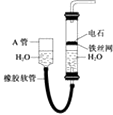
(1)制取乙炔的化学方程式是 .
(2)乙炔通入酸性KMnO4溶液中观察到的现象是 , 乙炔发生了反应.
(3)乙炔通入溴的CCl4溶液中乙炔发生了反应.
(4)将21g CH4和C2H2的混合气体通入盛有足量溴水的容器中,溴水的质量增加了13g,则混合气体中CH4与C2H2的体积比为 .
【答案】
(1)CaC2+2H2O→Ca(OH)2+CH≡CH↑
(2)酸性KMnO4溶液褪色;氧化
(3)加成
(4)1:1
【解析】解:(1.)制取乙炔的化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,所以答案是:CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2.)乙炔容易被高锰酸钾氧化,使高锰酸钾褪色,所以答案是:酸性KMnO4溶液褪色;氧化;
(3.)乙炔能够和溴水发生加成反应,溴的四氯化碳溶液褪色,所以答案是:加成.
(4.)CH4和C2H2的混合气体,通过足量的溴水充分吸收,溴水增重13g为C2H2质量,则CH4的质量=21g﹣13g=8g,
故n(CH4)= ![]() =0.5mol、n(C2H4)=
=0.5mol、n(C2H4)= ![]() =0.5mol,
=0.5mol,
相同条件下体积之比等于物质的量之比,故V(CH4):V(C2H2)=0.5mol:0.5mol=1:1,所以答案是:1:1.

练习册系列答案
相关题目


