题目内容
8.在一密闭容器中有HCHO、H2、O2共26.5g,用电火花引燃烧,使其完全燃烧,再将燃烧后的气体用Na2O2充分吸收,Na2O2增重10.5g,则原混合气体中O2的物质的量是( )| A. | 0.5 mol | B. | 0.25 mol | C. | 0.27 mol | D. | 0.52 mol |
分析 甲醛完全燃烧生成二氧化碳和水,甲醛化学式可以改写为CO.H2,HCHO、H2、O2用电火花引燃烧,使其完全燃烧,再将燃烧后的气体用Na2O2充分吸收,发生的反应为HCHO+O2$\frac{\underline{\;点燃\;}}{\;}$CO2+H2O、O2+2H2$\frac{\underline{\;点燃\;}}{\;}$2H2O、2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,根据化学式知,完全反应后过氧化钠质量增加量为CO、H2质量,所以混合气体质量与过氧化钠质量增加质量之差为氧气质量,据此分析解答.
解答 解:甲醛完全燃烧生成二氧化碳和水,甲醛化学式可以改写为CO.H2,HCHO、H2、O2用电火花引燃烧,使其完全燃烧,再将燃烧后的气体用Na2O2充分吸收,发生的反应为HCHO+O2$\frac{\underline{\;点燃\;}}{\;}$CO2+H2O、O2+2H2$\frac{\underline{\;点燃\;}}{\;}$2H2O、2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,根据化学式知,完全反应后过氧化钠质量增加量为CO、H2质量,所以混合气体质量与过氧化钠质量增加质量之差为氧气质量,则氧气质量=26.5g-10.5g=16g,n(O2)=$\frac{16g}{32g/mol}$=0.5mol,故选A.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,明确反应前后过氧化钠质量增加质量成分是解本题关键,注意甲醛的改写方式,题目难度中等.

练习册系列答案
相关题目
19.在450℃、5.05×107Pa时,如果把1体积N2和3体积H2的混合物通入一个装有催化剂的密闭容器中反应达到平衡时,得到含NH352%(体积分数)的混合气体.在同温同压下向密闭容器中通入2体积N2和6体积H2,达到平衡时NH3的体积分数为( )
| A. | 大于52% | B. | 等于52% | C. | 小于52% | D. | 不能确定 |
3.某氯原子的质量为a g,12C原子的质量为b g,用NA表示阿伏加德罗常数.下列说法中不正确的是( )
| A. | 由该氯原子构成氯分子(Cl2)的相对分子质量为$\frac{24a}{b}$ | |
| B. | mg该氯原子的物质的量为$\frac{m}{aNA}$ mol | |
| C. | ng该氯原子所含的电子数为$\frac{17n}{aNA}$ | |
| D. | 1mol该氯原子的质量为aNA g |
13.同周期的A、B、C三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:H3CO4<H2BO4<HAO4,则下列判断正确的是( )
| A. | 原子半径 A>B>C | |
| B. | 阴离子的还原性按A、B、C的顺序由强到弱 | |
| C. | 非金属性 A>B>C | |
| D. | 气态氢化物的稳定性按A、B、C的顺序由弱到强 |
20.下列对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,原物质一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入稀盐酸后再加入硝酸银,产生白色沉淀,则原溶液一定有Cl- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,不一定有Ba2+ |
18.下列有关化学用语使用正确的是( )
| A. | H2O的电子式: | B. | 硫原子的原子结构示意图: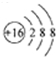 | ||
| C. | CO2的比例模型: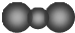 | D. | 基态氧原子的轨道表示式为: |


 .
.