题目内容
碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸氢钠的化学式是 ,俗称 。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为 。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者 后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为 。
【答案】
(1)NaHCO3 ;小苏打 (2)HCO3- + H+ = H2O + CO2↑;=
(3)2NaHCO3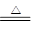 Na2CO3
+ H2O + CO2↑
Na2CO3
+ H2O + CO2↑
【解析】
试题分析:1)碳酸氢钠的化学式是NaHCO3,俗称小苏打。
(2)碳酸氢钠能和氢离子反应,所以碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为HCO3- + H+ = H2O + CO2↑;根据碳酸氢钠和碳酸钠的化学式NaHCO3、Na2CO3并依据碳原子守恒可知,等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者=后者。
(3)碳酸氢钠稳定性差,受热易分解生成碳酸钠、水和CO2,所以除去碳酸钠固体中碳酸氢钠的方法是加热,反应的化学化学方程式为2NaHCO3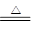 Na2CO3 + H2O
+ CO2↑。
Na2CO3 + H2O
+ CO2↑。
考点:考查碳酸氢钠的性质、用途、俗名、物质的分离与提纯、碳酸钠、碳酸氢钠与盐酸反应的计算、方程式的书写等
点评:该题是基础性试题的考查,难度不大。主要是考查学生对碳酸氢钠性质、用途等则知识的熟悉了解程度,意在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的规范答题能力。

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目


 Na2CO3+CO2↑+H2O。某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如图所示的一套实验装置:
Na2CO3+CO2↑+H2O。某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如图所示的一套实验装置: 