题目内容
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
(1)在标号元素中,最活泼的金属元素是 。最活泼的非金属元素是 。⑨元素的离子结构示意图是 。
(2)①与②形成共价化合物的电子式 。用电子式表示⑤与⑨形成化合物的形成过程 。
(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是 。
(4)⑦、⑧、⑨元素所形成的气态氢化物中,最稳定的是 。
⑦、⑧、⑨三种元素的最高价含氧酸的酸性由强到弱的顺序 。
(5)写出⑥元素的单质与盐酸反应的离子方程式: 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | | | | | | | |
| 二 | | | | ② | | ③ | ④ | |
| 三 | ⑤ | | ⑥ | ⑦ | ⑧ | | ⑨ | |
(1)在标号元素中,最活泼的金属元素是 。最活泼的非金属元素是 。⑨元素的离子结构示意图是 。
(2)①与②形成共价化合物的电子式 。用电子式表示⑤与⑨形成化合物的形成过程 。
(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是 。
(4)⑦、⑧、⑨元素所形成的气态氢化物中,最稳定的是 。
⑦、⑧、⑨三种元素的最高价含氧酸的酸性由强到弱的顺序 。
(5)写出⑥元素的单质与盐酸反应的离子方程式: 。
(1)Na F 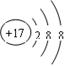
(2)
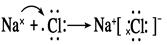
(3)Na>Al>Si
(4)HCl HClO4> H3PO4> H2SiO3
(5)2Al + 6H+ = 2Al3+ + 3H2↑

(2)

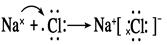
(3)Na>Al>Si
(4)HCl HClO4> H3PO4> H2SiO3
(5)2Al + 6H+ = 2Al3+ + 3H2↑
试题分析:同一周期的元素,随着原子序数的增大,元素的金属性逐渐减弱,非金属性逐渐增强;不同周期的元素,元素的原子核外电子层数越多,原子半径越大,原子失去电子的能力逐渐增强,得到电子的能力逐渐减弱,因此金属性逐渐增强。(1)所以在标号元素中,最活泼的金属元素是⑤的Na。最活泼的非金属元素是④的F。⑨元素Cl的离子结构示意图是
 .(2)①元素H与②元素C形成共价化合物CH4的电子式
.(2)①元素H与②元素C形成共价化合物CH4的电子式 。⑤Na与⑨Cl形成的离子化合物NaCl的形成过程电子式表示为:
。⑤Na与⑨Cl形成的离子化合物NaCl的形成过程电子式表示为: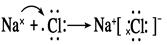 。(3)Na、Al、Si是同一周期的元素。随着原子序数的增大,原子的半径逐渐减小。因此这几种元素的原子半径大小关系为:Na>Al>Si。(4)Si、P、Cl是同种周期的元素。随着原子序数的增大,元素的非金属性逐渐增强,其形成的简单的氢化物的稳定性逐渐增强。元素的非金属性Cl>P>Si,所以气态氢化物中最稳定的是HCl。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以这三种元素的最高价含氧酸的酸性由强到弱的顺序是HClO4> H3PO4> H2SiO3 。(5)⑥Al元素的单质与盐酸反应的化学方程式为:2Al+6HCl=2AlCl3+ 3H2↑,其离子方程式为:2Al + 6H+ = 2Al3+ + 3H2↑。
。(3)Na、Al、Si是同一周期的元素。随着原子序数的增大,原子的半径逐渐减小。因此这几种元素的原子半径大小关系为:Na>Al>Si。(4)Si、P、Cl是同种周期的元素。随着原子序数的增大,元素的非金属性逐渐增强,其形成的简单的氢化物的稳定性逐渐增强。元素的非金属性Cl>P>Si,所以气态氢化物中最稳定的是HCl。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以这三种元素的最高价含氧酸的酸性由强到弱的顺序是HClO4> H3PO4> H2SiO3 。(5)⑥Al元素的单质与盐酸反应的化学方程式为:2Al+6HCl=2AlCl3+ 3H2↑,其离子方程式为:2Al + 6H+ = 2Al3+ + 3H2↑。
练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目

 、
、 、
、 、
、 、
、 、
、 中;
中;