题目内容
(12分)利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、NH4+、Cl一四种离子,
且c(NH4+)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是 。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性: 。
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是 。
(4)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量
如右图所示,B点溶液的pH=7(假设体积
可以直接相加),则c(HCl)= mol·L-1.

(5)在温度、容积相同的3个密闭容器中,
按下表投入反应物,发生反应(H2(g)+
I2(g) 2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
到平衡时的数据如下表:
下列说法正确的是 。
A.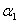 +
+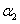 =1
B.2
=1
B.2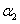 =
=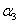 C.a+b=14.9
D.c1=c2=c3
C.a+b=14.9
D.c1=c2=c3

【答案】
(1)两种溶质是NH4Cl和NH3.H2O
(2)NH4++H2O NH3.H2O+H+
NH3.H2O+H+
(3)R2Z 、 RX 、RY(3分) (4)c(HCl)=0.2 mol·L-1.(3分)
(5)AC
【解析】略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
利用所学化学知识判断下列研究成果或报道可能不属实的是( )
| A、某地区发现了一种“柴油树”,它产生的树油可替代柴油使用 | B、新型材料碳纳米管的化学性质常温下很稳定 | C、华裔科学家高琨在光导纤维传输信息领域中取得突破性成就,光导纤维的主要成分是高纯度的单质硅 | D、蜘蛛丝(主要成分是蛋白质分子)强度特别大,可以用来制造防弹衣和降落伞绳 |


 2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达 +
+ =1
=1
