题目内容
(13分)铝土矿的主要成分是A12O3,含有Fe2O3、
SiO2等杂质,按下列操作从铝土矿中提取A12O3。
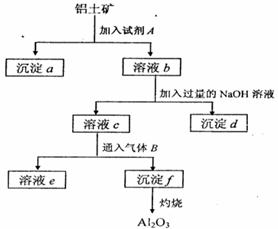
回答下列问题:
(1)沉淀物的化学式分别是:
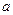
 ;d ;
;d ;
f ;
(2)写出加入过量NaOH溶液时所发生主要
反应的离子方程式 、
(3)写出通入气体B(过量)时溶液C中发生反应
的离子方程式 、 。
(4)气体B能否改用试剂A代替?为什么? , 。
。
SiO2等杂质,按下列操作从铝土矿中提取A12O3。

回答下列问题:
(1)沉淀物的化学式分别是:
 ;d ;
;d ;f ;
(2)写出加入过量NaOH溶液时所发生主要
反应的离子方程式 、
(3)写出通入气体B(过量)时溶液C中发生反应
的离子方程式 、 。
(4)气体B能否改用试剂A代替?为什么? ,
 。
。
略

练习册系列答案
相关题目
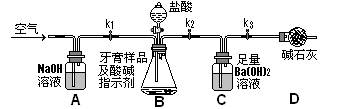
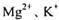 杂质离子并尽可能减少AlCI3的损失:请回答下列问题:
杂质离子并尽可能减少AlCI3的损失:请回答下列问题: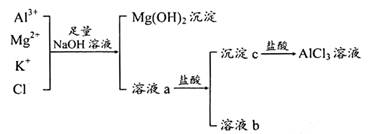
 硫酸转移到容量瓶中。
硫酸转移到容量瓶中。 盖上容量瓶塞子,振荡,摇匀。
盖上容量瓶塞子,振荡,摇匀。 ,当产生等质量的气体时,下列说法不正确的是
,当产生等质量的气体时,下列说法不正确的是