题目内容
【题目】肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图1。已知200℃时:
反应 I : 3N2H4(g)=N2(g)+4NH3(g) △Hl=-32.9kJ/mol
反应II: N2H4(g)+H2(g)=2NH3(g) △H2=-41.8 kJ/mol

下列说法不正确的是
A. 图l所示过程①、②都是放热反应
B. 反应Ⅱ的能量过程示意图如图2所示
C. 断开3 molN2H4(g)中的化学键吸收的能量大于形成1 molN2(g)和4 molNH3(g)中的化学键释放的能量
D. 200℃时,肼分解生成氨气和氢气的热化学方程式为N2H4(g) =N2(g)+2H2 (g) △H=+50.7 kJ/mol
【答案】C
【解析】A. 图l所示过程①、②发生的反应分别是Ⅰ、Ⅱ,两个反应焓变都为负值,所以都是放热反应,故A正确;B. 反应Ⅱ是放热反应,图2所示的能量过程示意图正确,B正确;C.由于反应I为放热反应,因此断开3 molN2H4(g)中的化学键吸收的能量小于形成1 molN2(g)和4 molNH3(g)中的化学键释放的能量,C错误;D.根据盖斯定律:I-2![]() 得N2H4(g)=N2(g)+2H2 (g) △H=+50.7 kJ/mol,D正确。答案选C.
得N2H4(g)=N2(g)+2H2 (g) △H=+50.7 kJ/mol,D正确。答案选C.

【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 气体发生装置 |
① | 制氧气 | H2O2―→O2 | |
② | 制氨气 | NH4Cl―→NH3 | |
③ | 制氯气 | HCl―→Cl2 |
(1)上表气体中:从制备过程看,必须选择合适的氧化剂才能实现的是____填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是________。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中_______。
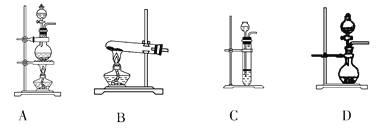
(3)若用上述制备O2的装置制备NH3,则选择的试剂为________________。
(4)制备Cl2需用8 mol·L-1的盐酸100 mL,现用12 mol·L-1的盐酸来配制。
①为提高配制的精确度,量取浓盐酸的仪器可选用下列中的______填序号):

②配制过程中,除上图所列仪器外,还需要的仪器有________、________、______。

