题目内容
某一反应体系中,有反应物和生成物共六种物质,这六种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中Cl2、H2O均为生成物。
(1)该反应中的氧化剂是 ,氧化产物为 。
(2)该反应中,氧化产物与还原产物的物质的量之比为 。
(3)若产生的气体在标准状况下体积为2.24 L,则反应过程中转移电子的数目为 NA(NA表示阿伏伽德罗常数的值),发生反应的KMnO4的质量为 g。
(1)该反应中的氧化剂是 ,氧化产物为 。
(2)该反应中,氧化产物与还原产物的物质的量之比为 。
(3)若产生的气体在标准状况下体积为2.24 L,则反应过程中转移电子的数目为 NA(NA表示阿伏伽德罗常数的值),发生反应的KMnO4的质量为 g。
(1)KMnO4 Cl2 (2)5:2 (3)0.2 6.32
试题分析:由该体系中的物质可以得知,该反应为实验室制备氯气的反应,2KMnO4+16HCl(浓)= 5Cl2+ 2MnCl2+ 8H2O+ 2KCl。其中,KMnO4被还原,作氧化剂;Cl2是氧化产物,MnCl2是还原产物;若产生的气体在标准状况下体积为2.24 L,则为0.1mol Cl2,转移的电子数目为0.2mol,发生反应的KMnO4的物质的量为0.04mol。
点评:氧化还原反应是高考的必考内容,考生应把握以下两点:一、判断一个反应是否属于氧化还原反应,以及氧化剂(产物)、还原剂(产物)分别是什么;二、利用得失电子配平所给化学反应,并能进行简单的有关于电子守恒的计算。

练习册系列答案
相关题目
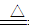 N2O↑+2H2O
N2O↑+2H2O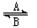 Fe3+。在过程A中,Fe2+作 剂。
Fe3+。在过程A中,Fe2+作 剂。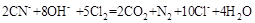 。下列判断错误的是
。下列判断错误的是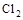
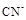 >
>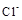
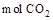 生成时,溶液中阴离子的物质的量增加1
生成时,溶液中阴离子的物质的量增加1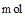
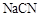 的水溶液呈碱性,说明
的水溶液呈碱性,说明