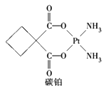
题目内容
【题目】某工厂废料中含有一定量的单质银。该工厂设计回收单质银的工艺流程如下:

已知:
i.NaClO在酸性条件下易分解,且NaClO氧化Ag的效果远强于NaClO3;
ii.3NaClO![]() 2NaCl+NaClO3。
2NaCl+NaClO3。
请回答下列问题:
(1)“粉碎”的目的为___。
(2)“浸出”时,需加入适量NaCl并保持体系为碱性环境,其中需保持体系为碱性环境的原因为___,发生反应的离子方程式为___。
(3)“浸出”时,所加NaClO可用代替___ (填选项字母),但此法的缺点是___。
A.HNO3 B.NaCl C.Na2S
(4)“溶解”时,发生反应的离子方程式为___。
(5)“还原”时,N2H4·H2O对应的产物为N2。此反应中氧化剂与还原剂的物质的量之比为___。
【答案】增大接触面积,提高后续银的浸出速率 防止NaClO分解成NaCIO3降低氧化效果 2Ag+ClO+Cl+H2O=2AgCl+2OH A 产生氮氧化物,污染环境 AgCl+2NH3H2O=[Ag(NH3)2]++Cl+2H2O 4:1
【解析】
(1)“粉碎”的目的为增大接触面积,提高后续银的浸出速率;
(2)保持体系为碱性环境,为防止NaClO分解成NaClO3降低氧化效果;
(3)“浸出”时需要氧化剂,所加NaClO可用HNO3代替,但产生氮氧化物;
(4)“溶解”时,根据反应物和产物的判断可得发生反应的离子方程式为AgCl+2NH3H2O=[Ag(NH3)2]++Cl-+2H2O;
(5)“还原”时,N2H4H2O对应的产物为N2,转移电子数为4,氧化剂为+1价的银,转移电子数为1。
(1)“粉碎”的目的为增大接触面积,提高后续银的浸出速率;
(2)“浸出”时,需加人适量NaClO并保持体系为碱性环境,其中需保持体系为碱性环境的原因为防止NaClO分解成NaClO3降低氧化效果,发生反应的离子方程式为2Ag+ClO+Cl+H2O=2AgCl+2OH;
(3)“浸出”时需要氧化剂,所加NaClO可用HNO3代替,但此法的缺点是产生氮氧化物,污染环境;
(4)“溶解”时,根据反应物和产物的判断可得发生反应的离子方程式为AgCl+2NH3H2O=[Ag(NH3)2]++Cl+2H2O;
(5)“还原”时,N2H4H2O对应的产物为N2,转移电子数为4,氧化剂为+1价的银,转移电子数为1,所以氧化剂与还原剂的物质的量之比为4:1。

【题目】I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
i. SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+SO2=SO![]() +4H++2I-
+4H++2I-
序号 | ① | ② | ③ | ④ |
试剂 组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验 现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较①快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较①快 |
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中),下列说法不正确的是
A. 水溶液中SO2歧化反应方程式为:3SO2+2H2O =S↓+2H2SO4
B. ②是①的对比实验,则a=0.4
C. 比较①、②、③,可得出结论:I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可加快歧化反应速率
D. 实验表明,SO2的歧化反应速率④>①,原因是反应i比ii快,反应ii中产生的H+是反应i加快