题目内容
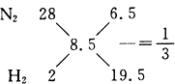
有平均相对分子质量为8.5的氢、氮混合气体,通过合成塔后出来的混合气体的平均相对分子质量为9.4,求H2的转化率。
19.15%
解析:
N2 + 3H2![]() 2NH3
2NH3
起始量 1 3 0
转化量 a 3a 2a
平衡量 1-a 3-3a 2a
由题意知:![]() =9.4
=9.4
![]() =9.4 a=0.191 5 转化率:
=9.4 a=0.191 5 转化率:![]() ×100%=19.15%。
×100%=19.15%。

练习册系列答案
相关题目
题目内容
有平均相对分子质量为8.5的氢、氮混合气体,通过合成塔后出来的混合气体的平均相对分子质量为9.4,求H2的转化率。
19.15%
解析:

N2 + 3H2![]() 2NH3
2NH3
起始量 1 3 0
转化量 a 3a 2a
平衡量 1-a 3-3a 2a
由题意知:![]() =9.4
=9.4
![]() =9.4 a=0.191 5 转化率:
=9.4 a=0.191 5 转化率:![]() ×100%=19.15%。
×100%=19.15%。
