题目内容
Ⅰ在催化剂作用下,CO2和H2可以制取甲醇。用工业废气中的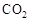 可制取甲醇,其反应为:CO2+3H2
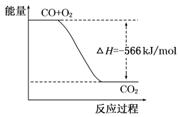
可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:

写出由二氧化碳和氢气制备甲醇的热化学方程式: 。
Ⅱ硼氢化钠(NaBH4)是有机合成中的重要还原剂。最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:
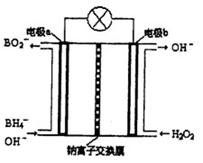
(1)电极b为 (填“正极”或“负极”),电极a上发生反应的电极反应式为 。
(2)电池工作时,Na+向 极(填“a”或“b”)移动,当左槽产生0.0125molBO2—离子时,右槽溶液pH=
(3)用该电池电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1molCu(OH)2,溶液恢复到电解之前状态,则电解过程中转移电子数目为_________
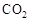 可制取甲醇,其反应为:CO2+3H2
可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
写出由二氧化碳和氢气制备甲醇的热化学方程式: 。
Ⅱ硼氢化钠(NaBH4)是有机合成中的重要还原剂。最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:

(1)电极b为 (填“正极”或“负极”),电极a上发生反应的电极反应式为 。
(2)电池工作时,Na+向 极(填“a”或“b”)移动,当左槽产生0.0125molBO2—离子时,右槽溶液pH=
(3)用该电池电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1molCu(OH)2,溶液恢复到电解之前状态,则电解过程中转移电子数目为_________
ⅠCO2(g)+3H2(g)=CH3OH(l)+H20(l) △H=-50kJ/mol
Ⅱ.(1)正 BH4-+8OH- -8e- =BO2- +6H2O (2)b 13 (3)0.4NA
Ⅱ.(1)正 BH4-+8OH- -8e- =BO2- +6H2O (2)b 13 (3)0.4NA
试题分析:Ⅰ如图所示可以得出两个热化学方程式:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol;2H2(g)+CO(g)=CH3OH(l) △H=-510kJ/mol;根据盖期定律,用后面的方程式减去前者方程式可得:CO2(g)+3H2(g)=CH3OH(l)+H20(l) △H=-50kJ/mol。(1)正极电极反应式为H2O2+2e-=2OH-,故电极b为正极,负极发生氧化反应生成BO2-,电极a反应式为BH4-+8OH--8e-=BO2-+6H2O。(2)原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区。当左槽产生0.0125molBO2—离子时,根据电子守恒,右槽生成氢氧根离子0.1mol,右槽溶液pH=13。(3)根据电子守恒原理,用该电池电解一定浓度的CuSO4溶液至无色后继续电解一段时间。电解方程式为:2CuSO4 + 2H2O =" 2Cu" + O2 + 2H2SO4 ,向溶液中加入0.1molCu(OH)2,溶液恢复到电解之前状态,说明有0.1mol硫酸生成,则电解过程中转移电子数目为0.2mol。

练习册系列答案
相关题目
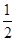 O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol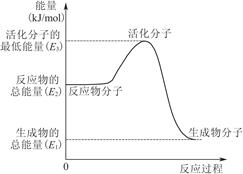
 2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ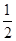 O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol