题目内容
14.(1)NO分子因污染空气而臭名昭著.近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”.请回答下列问题.①现代工业生产NO使用氨的催化氧化法,反应的化学方程式4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O
②在含Cu+(亚铜离子)的酶的活化中心,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式Cu++NO2-+2H+=Cu2++NO↑+H2O.
(2)酸牛奶中含有乳酸,其结构简式为:
 ,试写出:
,试写出:①乳酸跟足量金属钠反应的化学反应方程式CH2OHCH2COOH+2Na═CH2(ONa)CH2COONa+H2↑.
②乳酸跟少量碳酸钠反应的化学反应方程式2CH3C(OH)HCOOH+Na2CO3→2CH3C(OH)HCOONa+H2O+CO2↑.
(3)已知烃A蒸汽对氦气的相对密度是18,取3.6g 烃A在足量的氧气中充分燃烧,并将所得产物依次通过足量的浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重11g,求:
①该烃A的分子式(要求写出计算过程)
②若烃A的某种同分异构体的一氯代物只有一种,试写出该一氯代物的结构简式.
分析 (1)①NH3在催化作用下被氧化生成NO和水;
②亚铜离子具有还原性,能够被亚硝酸根离子氧化,生成铜离子,亚硝酸根离子被还原为一氧化氮;
(2)乳酸含有羟基和羧基,都可与钠反应生成氢气,羧基具有酸性;
(3)烃A蒸汽对氦气的相对密度是18,可知相对分子质量为18×4=72,3.6g 烃A的物质的量为$\frac{3.6g}{72g/mol}$=0.05mol,在足量的氧气中充分燃烧,并将所得产物依次通过足量的浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重11g,分别为水、二氧化碳的质量,计算二者的物质的量,可确定分子式,以此解答.
解答 解:(1)①NH3在催化作用下被氧化生成NO和水,方程式为4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O;
②亚铜离子与亚硝酸根离子发生氧化还原反应生成铜离子和一氧化氮,化学方程式为:Cu++NO2-+2H+=Cu2++NO↑+H2O.故答案为:Cu++NO2-+2H+=Cu2++NO↑+H2O;
(2)①乳酸含有羟基和羧基,都可与钠反应生成氢气,反应的方程式为CH2OHCH2COOH+2Na═CH2(ONa)CH2COONa+H2↑,
故答案为:CH2OHCH2COOH+2Na═CH2(ONa)CH2COONa+H2↑;
②羧基具有酸性,可与碳酸钠反应生成二氧化碳、钠盐和水,方程式为2CH3C(OH)HCOOH+Na2CO3→2CH3C(OH)HCOONa+H2O+CO2↑,
故答案为:2CH3C(OH)HCOOH+Na2CO3→2CH3C(OH)HCOONa+H2O+CO2↑;
(3)①烃A蒸汽对氦气的相对密度是18,可知相对分子质量为18×4=72,3.6g 烃A的物质的量为$\frac{3.6g}{72g/mol}$=0.05mol,在足量的氧气中充分燃烧,并将所得产物依次通过足量的浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重11g,分别为水、二氧化碳的质量,且n(CO2)=$\frac{11g}{44g/mol}$=0.25mol,n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,可知1mol烃含有5molC.12molH原子,则分子式为C5H12,
答:该烃A的分子式为C5H12;
②有机物A的某种同分异构体的一氯代物只有一种,该一氯代物的结构简式(CH3)3CCH2Cl,
答:该一氯代物的结构简式为(CH3)3CCH2Cl.
点评 本题考查有机物分子式的确定、限制条件同分异构体的书写,题目难度中等,注意利用等效H确定含有的甲基数目,书写结构式.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 不能发生消去反应 | B. | 能氧化为酮 | ||
| C. | 能与Na反应 | D. | 不能发生取代反应 |
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
| A. | 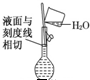 配制溶液 配制溶液 | B. | 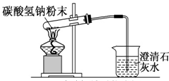 碳酸氢钠受热分解 碳酸氢钠受热分解 | ||
| C. | 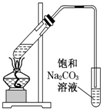 制备乙酸乙酯 | D. | 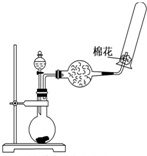 制备收集干燥的氨气 |
| A. | a<b | B. | a=b | C. | a>b | D. | 无法判断 |
| A. | 1mol FeCl3完全转化为Fe(OH)3胶体后生成NA个胶体粒子 | |
| B. | 在MnO2的作用下,1mol H2O2充分反应转移2NA个电子 | |
| C. | 在标准状况下,22.4L H2和4g He均含有NA个分子 | |
| D. | 46g NO2与92g N2O4均含有3NA个原子 |
 如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应,A、B、C都可以被强还原剂还原成为D(C6H14O6).下面的说法错误的是( )
如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应,A、B、C都可以被强还原剂还原成为D(C6H14O6).下面的说法错误的是( )| A. | 果糖与A属于同分异构体 | B. | A在酒化酶催化下能产生C2H5OH | ||
| C. | B和C都属于糖类 | D. | D是1,2,3,4,5,6-己六醇 |
 按要求对图中两极进行必要的联接并填空:其中a.b为惰性电极
按要求对图中两极进行必要的联接并填空:其中a.b为惰性电极