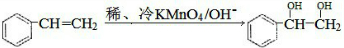题目内容
(2009?海南)下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
分析:A、镁原子失去2个电子形成镁离子,根据n=
计算镁的物质的量,再根据N=nNA计算失去的电子数;
B、使用物质的量必须指明具体的物质或化学式、微粒,盐酸溶质粒子为氢离子和氯离子,0.5mo1/L盐酸未告诉体积,无法计算;
C、根据n=
计算甲烷的物质的量,根据n=
计算水的物质的量,CH4与H2O每个分子都含有10个电子数,再根据N=nNA计算电子数;
D、CO气体所处的状态不一定是标准状况.
| m |
| M |
B、使用物质的量必须指明具体的物质或化学式、微粒,盐酸溶质粒子为氢离子和氯离子,0.5mo1/L盐酸未告诉体积,无法计算;
C、根据n=
| V |
| Vm |
| m |
| M |
D、CO气体所处的状态不一定是标准状况.
解答:解:A、2.4g金属镁变为镁离子时失去的电子数为
×2×NAmol-1=0.2NA,故A错误;
B、1molHCl气体中的粒子数,粒子指代不明确,盐酸溶质粒子为氢离子和氯离子,0.5mo1/L盐酸未告诉体积,无法计算,故B错误;
C、在标准状况下,22.4LCH4的物质的量为
=1mol,18gH2O的物质的量为
=1mol,CH4与H2O每个分子都含有10个电子数,所以在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA,故C正确;
D、CO气体所处的状态不一定是标准状况,不能使用气体摩尔体积22.4L/mol,无法计算其物质的量,不能比较,故D错误.
故选C.
| 2.4g |
| 24g/mol |
B、1molHCl气体中的粒子数,粒子指代不明确,盐酸溶质粒子为氢离子和氯离子,0.5mo1/L盐酸未告诉体积,无法计算,故B错误;
C、在标准状况下,22.4LCH4的物质的量为
| 22.4L |
| 22.4L/mol |
| 18g |
| 18g/mol |
D、CO气体所处的状态不一定是标准状况,不能使用气体摩尔体积22.4L/mol,无法计算其物质的量,不能比较,故D错误.
故选C.
点评:本题考查常用化学计量数的有关计算,难度不大,注意气体摩尔体积的使用条件与对象、使用物质的量必须指明具体的物质、微粒或化学式.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
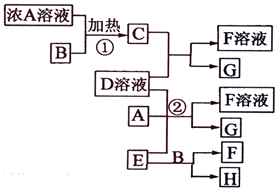 (2009?海南)有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
(2009?海南)有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
 .
.