题目内容
已知:S(s)+O2(g)→SO2(g) +297.16kJ,2SO2(g)+O2(g)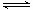 2SO3(g)+196.6
kJ,下列说法正确的是
2SO3(g)+196.6
kJ,下列说法正确的是
A.1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和
B.将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量
C.S(g)+O2(g) SO2(g)+Q,Q值小于297.16 kJ
SO2(g)+Q,Q值小于297.16 kJ
D.当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量
【答案】
D
【解析】
试题分析:A、S燃烧生成SO2的反应是放热反应,所以1
molSO2(g)的能量总和小于lmol S(s)和l molO2(g)的能量总和,A不正确;B、反应2SO2(g)+O2(g) 2SO3(g) 是可逆反应,反应物的转化率得不到100%,因此将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出的热量小于196.6kJ,B不正确;C、气态S的能量高于固态S的能量,所以气态S燃烧放出的热量多,即S(g)+O2(g)→SO2(g)+Q,Q值大于297.16 kJ,C不正确;D、根据盖斯定律可知,S(s)+
2SO3(g) 是可逆反应,反应物的转化率得不到100%,因此将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出的热量小于196.6kJ,B不正确;C、气态S的能量高于固态S的能量,所以气态S燃烧放出的热量多,即S(g)+O2(g)→SO2(g)+Q,Q值大于297.16 kJ,C不正确;D、根据盖斯定律可知,S(s)+ O2(g)→SO3(g),所以该反应放出的热量是297.16kJ+
O2(g)→SO3(g),所以该反应放出的热量是297.16kJ+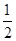 ×196.6 kJ=395.46kJ,D正确,答案选D。
×196.6 kJ=395.46kJ,D正确,答案选D。
考点:考查反应热的有关判断和计算

练习册系列答案
相关题目

 ,则X的结构简式为
,则X的结构简式为
 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g); 9N2(g)+12CO2(g)+12H2O(g);
9N2(g)+12CO2(g)+12H2O(g);
 O2+Hb?CO K=220
O2+Hb?CO K=220