题目内容
【题目】铝矾石(主要成分是Al2O3 , 还含有少量杂质SiO2、Fe2O3)是工业上用于炼铝的主要矿物之一,由铝矾石制取金属铝的工艺流程图如下: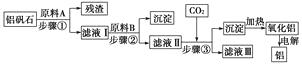
请回答下列有关问题:
(1)下列有关铝矾石以及用铝矾石炼铝的说法中,不正确的是( )
A.铝矾石中只含有金属氧化物
B.铝矾石与河沙含有相同的成分
C.铝矾石炼铝需要消耗电能
D.铝矾石炼铝的过程中不涉及置换反应
(2)原料A的名称是 , 步骤①用到的主要玻璃仪器有。
(3)滤液Ⅰ中要加入稍过量的原料B,原料B的化学式是 , 步骤②反应的离子方程式为。
(4)在步骤③中(填“能”或“不能”)用盐酸代替CO2 , 原因是。
【答案】
(1)A
(2)盐酸(或硫酸);烧杯、玻璃棒、漏斗
(3)NaOH;H++OH-=H2O、Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=Al(OH)4-
(4)不能;因为过量的盐酸会将Na[Al(OH)4]转化成AlCl3而得不到Al(OH)3沉淀
【解析】(1)铝矾石中含有的SiO2是非金属氧化物,故A项说法错误;河沙的主要成分为SiO2 , 故B项正确;电解法炼铝,必定消耗电能,C项正确;铝矾石炼铝的过程中涉及复分解反应、分解反应等,不涉及置换反应,故D项说法正确。(2)原料A溶解矿石,可利用强酸,分离出不溶物SiO2,步骤①为过滤操作,使用的玻璃仪器有:烧杯、玻璃棒、漏斗等。(3)步骤②中可加入强碱,沉淀出Fe3+ , 使Al3+转化为Al(OH)4-留在溶液里,通入CO2发生反应:CO2+Al(OH)4-=Al(OH)3↓+HCO3-;过滤得Al(OH)3沉淀,加热生成氧化铝,电解熔融的氧化铝得到铝。(4)Al(OH)3也能溶于盐酸,所以不能用盐酸代替CO2气体。
【考点精析】根据题目的已知条件,利用铝的化学性质的相关知识可以得到问题的答案,需要掌握很快与O2反应,形成致密氧化膜,抗腐蚀性比镁强;在纯氧中或高温下可燃烧;与沸水只有微弱反应.

【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO45H2O)及副产物ZnO.制备流程图如下: 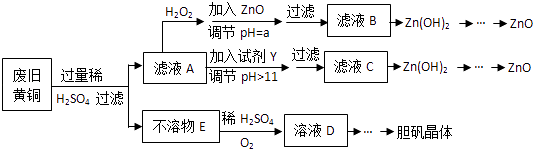
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算).
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)加入ZnO调节pH=a的目的是 , a的范围是 .
(2)由不溶物E生成溶液D的化学方程式为 .
(3)滤液A中加入H2O2反应的离子方程式为 .
(4)由溶液D制胆矾晶体包含的主要操作步骤是 .
(5)下列试剂可作为Y试剂的是 . A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是 .