题目内容
【题目】硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
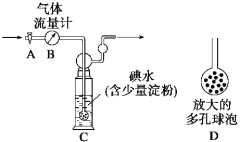
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是 。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种: 。
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量 (填“偏高”、“偏低”或“无影响”)。
乙方案:实验步骤如下面流程图所示:
![]()
(4)写出步骤②中反应的化学方程式 。
(5)步骤③中洗涤沉淀的方法是 。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液中,其余步骤与乙方案相同。
(6)你认为丙方案是否合理,说明理由: 。
【答案】(1)增大气体与溶液的接触面积,有利于SO2与碘水充分反应
(2)酸性高锰酸钾溶液(或其他合理答案)
(3)偏低
(4)H2SO4+Ba(OH)2===BaSO4↓+2H2O
(5)向漏斗里注入蒸馏水,使水面没过沉淀物,待水流尽后,重复操作2~3次
(6)不合理。亚硫酸钡容易被(氧气)部分氧化为硫酸钡
【解析】
试题分析:
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以增大SO2与碘水的接触面积,使SO2和碘水充分反应;
(2)二氧化硫能使酸性高锰酸钾溶液、溴水褪色,洗气瓶C中的溶液还可以用酸性高锰酸钾溶液、溴水等代替;
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,则通入尾气的体积增大,因此SO2含量偏低;
乙方案利用的原理为:SO2+H2O2=H2SO4,H2SO4+Ba(OH)2=BaSO4↓+2H2O,根据最后沉淀硫酸钡的质量计算尾气中二氧化硫的质量,进而计算尾气二氧化硫含量;
(4)步骤②中反应的化学方程式为:H2SO4+Ba(OH)2=BaSO4↓+2H2O;
(5)洗涤沉淀的方法是:向漏斗里注入蒸馏水,使水面没过沉淀物,待水流尽后,重复操作2~3次;丙方案:
(6)将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,BaSO3被部分氧化为BaSO4,导致测定的亚硫酸钡的质量偏大,测定二氧化硫的体积偏大,体积分数偏大,故不合理;。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案