题目内容
【题目】镁及其化合物有广泛用途。工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质)为原料制备纳米氧化镁的实验流程如下:
(1)加入H2O2氧化时,发生反应的离子方程式为___。
(2)在实验室煅烧滤渣2制得的金属氧化物为___(填化学式),需要的仪器除酒精灯、三脚架以外,还需要___(填序号)。
①蒸发皿 ②坩埚 ③泥三角 ④石棉网
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,反应的化学方程式为___。
(4)25℃时,加入CO(NH2)2至开始产生沉淀,溶液的pH=10时,c(Mg2+)=___molL-1(已知25℃,Ksp[Mg(OH)2]=1.8×10-11)。
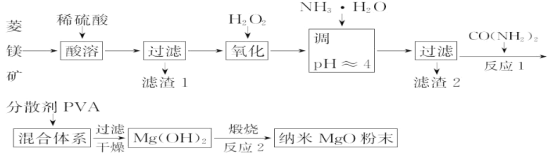
(5)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制备纳米MgO。如图1为反应温度对纳米MgO产率和粒径的影响,据图分析反应的最佳温度为___。
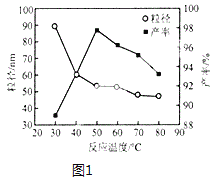
(6)Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图2如。该电池工作时,石墨电极发生的电极反应为___。
【答案】2Fe2++H2O2+2H+=2Fe3++2H2O Fe2O3 ②③ CO(NH2)2+3H2O=CO2↑+2NH3H2O 1.8×10-3 50°C H2O2+2e-=2OH-
【解析】
菱镁矿的主要成分为MgCO3、含SiO2以及少量FeCO3,酸溶时MgCO3、FeCO3与稀硫酸反应生成MgSO4、FeSO4,SiO2与稀硫酸不反应,过滤得到的滤渣1的主要成分为SiO2;向滤液中加入H2O2,H2O2将Fe2+氧化成Fe3+,加入NH3·H2O调pH≈4,Fe3+转化成Fe(OH)3沉淀而除去,滤渣2的主要成分为Fe(OH)3;滤液中加入CO(NH2)2使Mg2+转化为Mg(OH)2沉淀,煅烧Mg(OH)2得到纳米MgO粉末;据此分析作答。
(1)过氧化氢是绿色氧化剂,氧化亚铁离子不会引入新的杂质,氧化亚铁离子的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)滤渣2为氢氧化铁,煅烧氢氧化铁制得的金属氧化物是氧化铁,化学式为Fe2O3,煅烧固体需要在坩埚中进行,需要的仪器除酒精灯、三脚架以外,还需要坩埚、泥三角,答案选②③;
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,依据原子守恒可知弱碱为一水合氨,反应的化学方程式为:CO(NH2)2+3H2O=CO2↑+2NH3H2O;
(4)已知25℃,Ksp[Mg(OH)2]=1.8×10-11,加入CO(NH2)2至开始产生沉淀,溶液的pH=10,c(OH-)=![]() mol/L=10-4mol/L,Ksp[Mg(OH)2]= c(Mg2+)×c2(OH-)=1.8×10-11,则c(Mg2+)=1.8×10-3mol/L;
mol/L=10-4mol/L,Ksp[Mg(OH)2]= c(Mg2+)×c2(OH-)=1.8×10-11,则c(Mg2+)=1.8×10-3mol/L;
(5)图1为反应温度对纳米MgO产率和粒径的影响,据图分析50℃时氧化镁产率最大,反应的最佳温度为50℃;
(6)该原电池中,镁作负极,石墨作正极,正极上双氧水得电子生成氢氧根离子,电极反应式为H2O2+2e-=2OH-。

【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是__________________________________,生成物的化学式为___________
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于__________________
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______________________,写出有关化学反应方程式______________________________。