题目内容
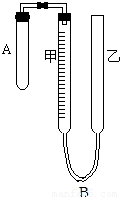
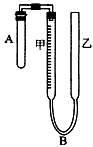
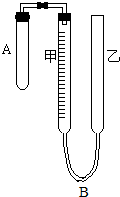 为了测定气体摩尔体积,用如图所示的装置和下列实验药品:将一定量锌片与足量的稀硫酸在试管A中反应,量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度,甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低.
为了测定气体摩尔体积,用如图所示的装置和下列实验药品:将一定量锌片与足量的稀硫酸在试管A中反应,量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度,甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低.
回答下列问题:
(1)写出锌和稀硫酸反应的化学方程式:______.
(2)如果发生反应的锌片质量为0.260克,实验测得生成的氢气体积为92mL,则这时的气体摩尔体积为______L?mol-1.
(3)如果甲管的刻度最大值是100mL,则实验中称取锌片的最大质量是______克.
(4)为了准确地测量H2的体积,在读取反应后甲管中液面的读数时,应注意______(填写序号).
A.视线与凹液面最低处相平
B.等待片刻,待乙管液面不再上升时读数
C.读数时应上、下移动乙管,使甲、乙两管液面相平
D.读数不一定使甲、乙两管液面相平.
解:(1)锌和稀硫酸反应生成硫酸锌和氢气,反应方程式为:Zn+H2SO4=ZnSO4+H2↑.
故答案为:Zn+H2SO4=ZnSO4+H2↑.
(2)设气体摩尔体积为Vm.
Zn+H2SO4=ZnSO4+H2↑
65g 1mol
0.260g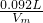
Vm= /mol=23.0L/mol.
/mol=23.0L/mol.
故答案为:23.0L/mol.
(3)设锌的最大质量为xg.
Zn+H2SO4=ZnSO4+H2↑
65g 1mol
xg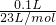
x=0.283
故答案为:0.283.
(4)为了较准确地测量氢气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数.读数时应注意:①读数时要调节甲乙的液面使其同一高度;②读数时视线要与凹液面最低处相平;③等待片刻,待乙管液面不再上升时读数.
故选ABC.
分析:(1)锌和稀硫酸反应生成硫酸锌和氢气.
(2)根据锌和氢气的关系式计算气体摩尔体积.
(3)收集的气体体积增大为100mL,根据锌和氢气的关系式计算锌的质量.
(4)在测量氢气体积时,为了使测量更为准确,要注意上下移动仪器乙管,使甲、乙两管的液面相平,以使甲管中的气压与大气气压相等,同时视线应与甲管内凹液面最低处相平,等待片刻,待乙管液面不再上升时读数,以减少观察误差.
点评:本题考查了物质的量的有关计算、量气等知识,题目难度中等,本题注意把握实验原理和操作方法,注重基础知识的积累.
故答案为:Zn+H2SO4=ZnSO4+H2↑.
(2)设气体摩尔体积为Vm.
Zn+H2SO4=ZnSO4+H2↑
65g 1mol
0.260g
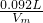
Vm=
 /mol=23.0L/mol.
/mol=23.0L/mol.故答案为:23.0L/mol.
(3)设锌的最大质量为xg.
Zn+H2SO4=ZnSO4+H2↑
65g 1mol
xg
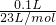
x=0.283
故答案为:0.283.
(4)为了较准确地测量氢气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数.读数时应注意:①读数时要调节甲乙的液面使其同一高度;②读数时视线要与凹液面最低处相平;③等待片刻,待乙管液面不再上升时读数.
故选ABC.
分析:(1)锌和稀硫酸反应生成硫酸锌和氢气.
(2)根据锌和氢气的关系式计算气体摩尔体积.
(3)收集的气体体积增大为100mL,根据锌和氢气的关系式计算锌的质量.
(4)在测量氢气体积时,为了使测量更为准确,要注意上下移动仪器乙管,使甲、乙两管的液面相平,以使甲管中的气压与大气气压相等,同时视线应与甲管内凹液面最低处相平,等待片刻,待乙管液面不再上升时读数,以减少观察误差.
点评:本题考查了物质的量的有关计算、量气等知识,题目难度中等,本题注意把握实验原理和操作方法,注重基础知识的积累.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
 为了测定气体摩尔体积,用如图所示的装置和下列实验药品:将一定量锌片与足量的稀硫酸在试管A中反应,量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度,甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低.
为了测定气体摩尔体积,用如图所示的装置和下列实验药品:将一定量锌片与足量的稀硫酸在试管A中反应,量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度,甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低. “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案: